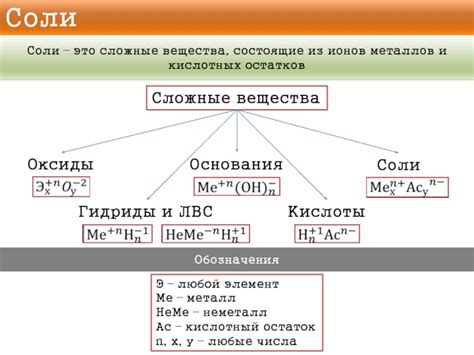
История изучения солей металлов насчитывает множество веков, начиная с древних греков и римлян. Соли металлов – это химические соединения, состоящие из положительно заряженного иона металла и отрицательно заряженного иона, известного как анион. Состав формул солей металлов может быть простым или сложным в зависимости от выбранного металла и аниона.
Простейшие соли металлов имеют составную формулу, в которой нет индексов. Например, хлорид натрия имеет формулу NaCl, где Na – ион натрия, а Cl – ион хлора. Это один из самых распространенных примеров солей металлов. Помимо него, существует множество других простейших солей, таких как оксиды, карбонаты, сульфаты и другие.
Состав формул сложных солей металлов становится более интересным и разнообразным. В этом случае формула включает индексы, которые показывают количество атомов различных элементов в соединении. Например, формула серного аммония – (NH4)2SO4. Здесь в формуле присутствуют скобки, которые обозначают группу NH4, и они умножают все атомы, которые входят в данную группу. Это делается для обозначения, что в соединении присутствуют две группы аммония.
В заключении можно сказать, что состав формул солей металлов может быть как простым, так и сложным. Важно понимать, что каждая формула отражает строение соединения и позволяет определить его состав и свойства. Соли металлов играют важную роль в различных отраслях науки и промышленности, поэтому изучение их формул является важной задачей для химиков и исследователей.
Простейшие соли металлов

Соли металлов – это химические соединения, которые образуются в результате реакции металла с кислотой или кислотной окисью. Простейшие соли металлов имеют простой состав и наиболее распространены среди всех видов солей.
Простейшие соли металлов обычно состоят из двух частей – катиона металла и аниона кислоты. Но могут быть и исключения, когда соль образуется из одной частицы металла без участия кислоты. Например, некоторые металлы могут образовывать оксиды, которые затем диссоциируются и образуют ионные соединения, не требующие участия кислоты.
Наиболее распространенными простейшими солями металлов являются сульфаты, хлориды и нитраты. Сульфаты содержат ион серы, хлориды – ион хлора, а нитраты – ион азота. Также, простейшие соли металлов можно разделить на две основные группы – соли однозарядных и соли многозарядных металлов.
Простейшие соли металлов можно узнать по их химической формуле, которая содержит символ металла и символ аниона. Например, хлорид натрия обозначается формулой NaCl, где Na – символ металла натрия, а Cl – символ аниона хлорида.
Соли металлов группы I

Соли металлов группы I, также известные как щелочные металлы (литий, натрий, калий, рубидий, цезий, франций), обладают сильными щелочными свойствами. Они активно реагируют с кислотами, образуя соли и выделяя водород.
В формулах солей щелочных металлов элемент щелочного металла обычно обозначается символом обозначения металла, например, Li, Na, K и т.д. Анион, который образует соль, обычно обозначается соответствующим обозначением соответствующего кислородного иона, таким как NO3-, SO4^2-, ClO4- и т.д.
Напримеp:
- Соль калия аваилабльна асидалас числидаксока sjakio: KCl
- Соль натрия называется хлорид натрия и имеет формулу NaCl
- Соль лития называется лития карбоната и имеет формулу Li2CO3
- Соль рубидия называется рубидия нитрата и имеет формулу RbNO3
- Соль цезия называется цезия сульфата и имеет формулу Cs2SO4
- Соль франция называется франция хлорида и имеет формулу FrCl
Соли металлов группы I находят широкое применение в разных областях жизни, включая пищевую промышленность, фармацевтику, сельское хозяйство и другие. Они играют важную роль в биохимии и являются необходимыми для нормального функционирования организма.
Соли металлов группы II

Соли металлов группы II, также известные как щелочноземельные металлы, включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они являются химически активными элементами, которые образуют разнообразные соединения.
Соли этих металлов обычно имеют ионную структуру и состоят из положительных ионов металла и отрицательных ионов аниона. Бериллий образует соли с анионами, примерами которых могут быть бериллиевые фосфаты и бериллиевые сульфаты.
Магний, кальций и другие щелочноземельные металлы также образуют различные соли. Например, магний может образовывать магниевые хлориды, магниевые сульфаты и магниевые нитраты. Кальций, в свою очередь, может образовывать кальциевые карбонаты, кальциевые фосфаты и кальциевые хлориды.
Стронций образует стронциевые соли, такие как стронциевый нитрат и стронциевый бромид. Барий образует бариевые соли, например, бариевый сульфат и бариевый хлорид. Радий, самый редкий и радиоактивный из всех щелочноземельных металлов, образует радиевые соли, включая радиевый хлорид и радиевый нитрат.
Соли металлов группы II широко используются в различных отраслях промышленности и научных исследованиях, благодаря своим уникальным химическим свойствам и возможностям реакций с другими веществами. Они играют важную роль в производстве пигментов, керамики, лекарственных препаратов, селитров и многих других веществ.
Соли переходных металлов

Переходные металлы – это элементы, которые находятся в переходной группе периодической системы. Они представляют собой широкую группу элементов, которые обладают разнообразием свойств и способностей. Соли, содержащие переходные металлы, обладают особыми химическими свойствами, которые определяются их дефектной структурой и изменчивостью валентности металла.
Соли переходных металлов часто имеют сложные структуры, состоят из положительного и отрицательного ионов, и образуют многочисленные кристаллогидраты. Однако, в отличие от солей простых металлов, соли переходных металлов могут образовывать ионы разной валентности, что делает их реактивность более разнообразной.
Примером солей переходных металлов является сульфат меди(II) – CuSO4. Эта соль имеет синюю окраску и широко используется в химической промышленности, в процессах электролиза и как растворитель. Еще одним примером является хлорид железа(III) – FeCl3. Эта соль образует желтые кристаллы и используется в качестве катализатора во многих органических реакциях.
Соли переходных металлов широко применяются в промышленности, медицине, электротехнике и других областях. Их свойства и применение во многом определяются их составом и структурой, которые можно менять, создавая новые вещества с уникальными свойствами и функциональностью.
Сложные соли металлов
Сложные соли металлов представляют собой химические соединения, в которых металл образует ионы с различными степенями окисления и соединяется с другими элементами, образуя разнообразные анионы. Эти соединения встречаются как в природе, так и получаются искусственным путем в ходе химических реакций.
Сложные соли металлов можно разделить на несколько типов. Один из них – гидратные соли, в которых молекулы воды входят в состав кристаллической решетки вместе с ионами металла. Эти соли могут иметь различное количество встроенных молекул воды, что влияет на их физические свойства.
Еще один тип – комплексные соли, в которых металл образует координационные соединения с органическими или неорганическими лигандами. Лиганды могут быть полиатомными ионами или нейтральными молекулами, и они образуют структуру вокруг иона металла. Комплексные соли обладают уникальными свойствами и широко используются в различных областях науки и техники.
Некоторые сложные соли металлов широко применяются в жизни. Например, нитрат цинка (Zn(NO3)2) используется в качестве удобрения для растений. Сульфат железа (FeSO4) применяется в медицине для лечения анемии. Ацетат свинца (Pb(C2H3O2)2) используется в качестве консерванта в пищевой промышленности. Также сложные соли металлов широко используются в химическом производстве, в процессе производства лекарств, электролитических растворов и многих других областях.
Состав сложных соединений солей металлов

Состав сложных соединений солей металлов определяется наличием нескольких ионов в структуре. В таких соединениях металл может образовывать несколько видов ионов с различной зарядностью, что позволяет создавать более сложные и разнообразные соединения.
Один из примеров сложных соединений солей металлов - полихлориды металлов. В таких соединениях один металл имеет различную степень окисления и образует ионы с различными зарядами. Например, в полихлориде железа, FeCl3, железо может образовывать ионы Fe3+ и Fe2+.
Еще одним примером сложных соединений солей металлов являются карбонаты металлов. Карбонатные ионы CO32- связываются с металлическими ионами, образуя структуру карбоната металла. Например, в карбонате кальция, CaCO3, ионы кальция Ca2+ соединяются с карбонатными ионами CO32-.
Также стоит упомянуть о тетраокисамирахутах металлов - соединениях, в которых крупные металлические ионы окружены легкими анионами. Например, тетраокисамирахут натрия, Na2[MoO4], образуется благодаря соединению двух натриевых ионов Na+ и двух оксимолябденатных ионов MoO42-.
Состав сложных соединений солей металлов может быть очень разнообразным и определяется взаимодействием различных ионов внутри структуры. Это создает большую вариативность и разнообразие свойств таких соединений.
Вопрос-ответ

Какие элементы могут составлять соли металлов?
Соли металлов могут содержать различные элементы, но чаще всего это ионы металлов, такие как натрий (Na+), калий (K+), магний (Mg2+), кальций (Ca2+) и т. д.
Каково строение простейших солей металлов?
Строение простейших солей металлов можно представить в виде кристаллической решетки, в которой положительно заряженные ионы металла окружены отрицательно заряженными анионами. Например, в соли натрия (NaCl) положительные ионы натрия окружены отрицательными ионами хлора.
