Метод вытеснения водорода является одним из методов, используемых в химии для определения молярной массы эквивалентов металла. Он основан на принципе, согласно которому металл может вытеснить водород из его соединения, и освободившийся при этом объем водорода пропорционален количеству металла в соединении.
Для проведения эксперимента необходимо взять определенное количество металла и поместить его в кислотное растворение. В результате реакции происходит выделение водорода, который можно заметить по определенным признакам - образованию пузырей, повышению температуры и др.
Далее, необходимо собрать образец выделенного водорода в градуированную, заполненную водой пробирку и измерить его объем. Затем установить соотношение, определяющее мольные отношения между металлом и водородом. После этого можно использовать полученные данные для вычисления молярной массы эквивалентов металла.
Метод вытеснения водорода является точным и довольно простым способом определения молярной массы эквивалентов металла. Он широко используется в химических исследованиях и позволяет получить достоверные результаты, не требуя сложного оборудования или специальной подготовки.
Метод вытеснения водорода
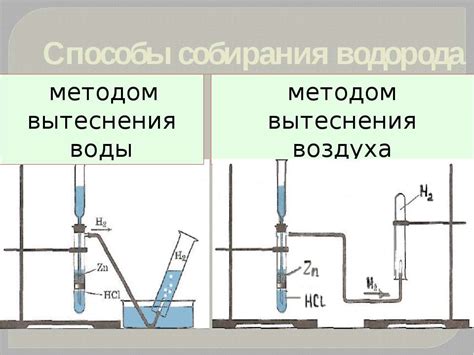
Метод вытеснения водорода – это аналитический метод, используемый для определения молярной массы эквивалентов металла.
Основная идея метода заключается в том, что металл способен вытеснить водород из раствора кислоты. При этом изменяется масса металла, которая может быть определена экспериментально.
Для проведения эксперимента необходимо взять известную массу металла и погрузить его в кислоту. В процессе реакции водород будет образовываться и выделится в виде пузырьков. Следует отметить, что вытесняется только один эквивалент водорода на один эквивалент металла.
После проведения эксперимента необходимо измерить массу металла до и после реакции. Разность этих масс и будет являться массой вытесненного водорода. Зная количество вытесненного водорода и массу металла, можно рассчитать его молярную массу эквивалентов.
Метод вытеснения водорода широко применяется в химическом анализе для определения молярной массы различных металлов и исследования их химических свойств.
Понятие молярной массы

Молярная масса – это физическая величина, которая определяет массу одного моля вещества. Молярная масса является основным понятием в химии и используется для вычисления различных химических параметров. Молярная масса обозначается символом М и измеряется в г/моль.
Вычисление молярной массы производится путем сложения атомных масс всех атомов, составляющих молекулу вещества. Масса атомов определяется относительно единицы массы – атомной массовой единицы (а.е.м.), которая равна одной двенадцатой части массы углерод-12. Атомная массовая единица равна примерно 1,66 × 10^-24 г.
Молярная масса вещества является числовой величиной и позволяет выразить массу одного моля атомов или молекул данного вещества в граммах. Например, молярная масса кислорода (О2) равна 32 г/моль, что значит, что масса одного моля кислорода составляет 32 г.
Знание молярной массы вещества позволяет проводить различные расчеты, связанные с количеством вещества, массой и объемом реакционной смеси. Также молярная масса необходима при проведении экспериментов, в которых требуется точное дозирование вещества для получения определенного количества продукта реакции.
Значение эквивалента

Значение эквивалента металла является важным параметром при проведении опытов, связанных с его химическими свойствами. Эквивалент - это количество вещества, которое способно образовать определенное количество реагента или принять участие в химической реакции. В случае металлов, эквивалент определяется как масса металла, соединенная с одним электроном, вступающим в реакцию.
Для определения эквивалента металла, работники лаборатории часто используют метод вытеснения водорода. Этот метод основан на реакции между металлом и кислотой, при которой образуется водород. Измеряя количество выделенного водорода, можно определить количество металла, вступившего в реакцию и, следовательно, его эквивалент.
Знание значения эквивалента металла позволяет проводить расчеты при проведении экспериментов. Например, при решении задач по химии, где требуется определить молярную массу металла, можно использовать значение эквивалента для преобразования массы металла в количество вещества. Это позволяет получить более точные результаты и провести более полный анализ химической реакции.
Более того, значение эквивалента металла является фундаментальным параметром в химических расчетах и может быть использовано для определения других химических свойств металла, таких как его активность, химическая реакционная способность и др. Поэтому знание значения эквивалента металла имеет большое практическое и научное значение.
Описание метода

Метод вытеснения водорода является одним из способов определения молярной массы эквивалентов металла. Он основан на реакции между металлом и кислотой, в результате которой образуется водород. Этот метод применяется для определения молярной массы эквивалентов металла, если невозможно использовать другие методы из-за сложности или недоступности исследуемого вещества.
Принцип метода заключается в вытеснении водорода из кислотного раствора металлическим образцом металла. Металлический образец помещается в кислотный раствор, при этом происходит реакция металла с кислотой, в результате которой образуется водород. Образующийся водород собирается и измеряется, а затем вычисляется его объем. По объему вытесненного водорода и его массе определяется молярная масса эквивалентов металла.
В процессе определения молярной массы эквивалентов металла при помощи метода вытеснения водорода необходимо учесть такие факторы, как температура и давление воздуха в помещении, где происходит реакция, а также загрязнение образца металла или кислотного раствора. Для достоверности результатов рекомендуется проводить несколько опытов с разными образцами металла и усреднять полученные значения.
Метод вытеснения водорода широко применяется в химическом анализе для определения молекулярных масс веществ. Он является относительно простым и доступным способом определения молярной массы эквивалентов металла, однако требует точности и аккуратности при проведении эксперимента. Результаты, полученные при помощи этого метода, могут быть использованы в различных областях, таких как материаловедение, металлургия и промышленность.
Принцип метода вытеснения водорода

Метод вытеснения водорода, также известный как метод стандартного водородного электрода (МCВЭ), является одним из методов определения молярной массы эквивалентов металла. Он основан на принципе соревнования между металлом и водородом за активные места на поверхности металла.
Для проведения данного метода необходимо иметь специальную установку, состоящую из стеклянного сосуда, в котором находится раствор исследуемого металла, а также стандартного водородного электрода с насыщенным раствором соляной кислоты. Между этими электродами действует разность потенциалов, что позволяет провести наблюдения и измерения.
Принцип метода основан на том, что активное место на поверхности металла может занять водород или сам металл. Если водород успевает занять данное место, то его присутствие будет обнаруживаться с помощью изменения электродного потенциала. При установленных условиях проведения эксперимента можно определить молярную массу эквивалентов металла по реакциям вытеснения водорода.
Измерение потенциала позволяет оценить скорость реакции вытеснения водорода, а также определить константу скорости и чувствительность кинематического метода, что в свою очередь позволяет определить молярную массу эквивалентов металла и провести его характеристику.
Шаги проведения эксперимента:
1. Подготовка образца металла: весом точно измеряем порцию металлического образца. Для увеличения контактной площади образца с реагентами, его поверхность иногда предварительно обезжиривают.
2. Подготовка раствора кислоты: в зависимости от конкретной задачи подбирается оптимальная концентрация кислоты для проведения эксперимента. Раствор приготавливают с использованием дистиллированной воды и точно измеренного количества кислоты.
3. Использование системы сбора газов: для измерения выделяющегося водорода необходимо подготовить систему сбора, состоящую из газоотводного аппарата и воды, препятствующей выходу газа, но позволяющей его коллекционировать.
4. Проведение эксперимента: образец металла помещают в реакционную колбу с кислотой, после чего аккуратно укрепляют аппаратуру для сбора газа. По мере результатров собираются данные о объеме выделившегося водорода.
5. Расчет молярной массы: по полученным данным о массе образца металла и объеме выделившегося водорода производится расчет молярной массы эквивалентов металла по формуле, учитывающей стехиометрические соотношения.
6. Анализ результатов и выводы: полученные значения молярной массы металла сравниваются с литературными данными для оценки точности используемого метода и возможных погрешностей эксперимента.
Решение молярной массы
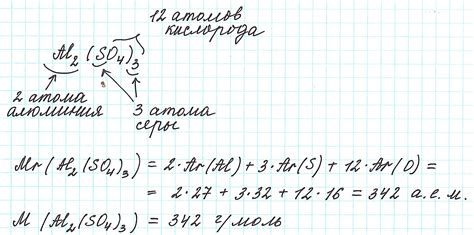
Молярная масса - это масса одного моля вещества. Она выражается в г/моль и является фундаментальной характеристикой вещества. Решение молярной массы имеет важное значение в химических расчетах, таких как определение стехиометрических соотношений и расчеты массы реактивов и продуктов реакции.
Существует несколько способов решения молярной массы вещества. Один из них - метод вытеснения водорода. Этот метод основан на принципе, что металл может вытеснить водород из кислотного раствора. Расчет молярной массы металла осуществляется путем измерения объема выделившегося водорода и массы реагента.
Для решения молярной массы вещества при помощи метода вытеснения водорода необходимо знать стехиометрическое соотношение реакции, то есть количество вещества металла и кислоты, участвующих в реакции. Зная массу металла и объем выделившегося водорода, можно рассчитать молярную массу металла по формуле: масса металла / общее количество молей металла в реакции.
Решение молярной массы эквивалентов металла при помощи метода вытеснения водорода является эффективным и точным способом определения массы металла. Он находит широкое применение в химических исследованиях, аналитической химии и промышленных процессах.
Пример выполнения расчетов

Рассмотрим конкретный пример расчета молярной массы эквивалентов металла при помощи метода вытеснения водорода. Пусть имеется 0,1 М раствор серной кислоты (H2SO4), который реагирует с алюминием (Al) и выделяет газ водород (H2).
1. Известно, что объем выделившегося газа составил 44,8 мл. Переведем этот объем в литры, умножив его на коэффициент перевода: 44,8 мл * 10-3 л/мл = 0,0448 л.
2. По уравнению реакции, известно, что на одну молекулу серной кислоты (H2SO4) выделяется одна молекула водорода (H2). Значит, количество молекул водорода равно количеству молекул серной кислоты. Так как раствор серной кислоты имеет концентрацию 0,1 М, то количество молекул серной кислоты можно найти по формуле:
Количество молекул H2SO4 = Концентрация (М) * Объем (л) = 0,1 М * 0,0448 л = 0,00448 моль.
3. Так как на одну молекулу серной кислоты (H2SO4) выделяется две молекулы водорода (H2), то количество молекул водорода равно удвоенному количеству молекул серной кислоты:
Количество молекул H2 = 2 * Количество молекул H2SO4 = 2 * 0,00448 моль = 0,00896 моль.
4. Теперь найдем число граммов выделившегося водорода. Для этого умножим количество молекул H2 на его молярную массу, которая равна 2 г/моль:
Масса H2 = Количество молекул H2 * Молярная масса H2 = 0,00896 моль * 2 г/моль = 0,01792 г.
5. Полученную массу водорода (0,01792 г) сравним с массой вытесненного металла (алюминия). Пусть масса алюминия составила, например, 0,1 г. Тогда молярная масса эквивалентов алюминия будет равна:
Молярная масса эквивалентов Al = Масса алюминия / Масса H2 = 0,1 г / 0,01792 г/моль = 5,58 г/моль.
Выбор металла и реагента
При выборе металла для проведения эксперимента по определению молярной массы эквивалентов металла при помощи метода вытеснения водорода нужно учитывать несколько факторов.
Во-первых, металл должен быть реактивным и способным вытеснять водород из связей с кислородом, образуя при этом воду. Некоторые металлы, такие как цинк (Zn), алюминий (Al) и магний (Mg), хорошо подходят для этой цели.
Во-вторых, металл должен быть легко доступным и иметь достаточно высокую чистоту. Это позволяет получить точные результаты эксперимента. Например, алюминий можно приобрести в виде специальных фольгированных листов, которые легко разрезать на небольшие кусочки для проведения эксперимента.
Реагентом, который используется в эксперименте, является раствор соляной кислоты (HCl). Этот реагент способен растворять металл и образовывать водородный газ в процессе реакции. Соляная кислота широко доступна и обычно имеет достаточно высокую степень очистки.
Таким образом, выбор металла и реагента является важным шагом при планировании и проведении эксперимента по определению молярной массы эквивалентов металла при помощи метода вытеснения водорода. Нужно выбирать реактивные металлы, которые легко доступны и имеют высокую чистоту, а также использовать качественный реагент, способный эффективно реагировать с металлом и образовывать газ.
Использование уравнения реакции

Уравнение реакции для определения растворимости металла в кислоте позволяет нам рассчитать молярную массу эквивалента металла. Реакция метода вытеснения водорода основана на использовании водорода в качестве редуцирующего агента.
В уравнении реакции присутствуют две основные составляющие: металл и кислота. Металл действует как восстановитель, вытесняя водород из кислоты. Кислота, в свою очередь, выступает в роли окислителя, принимая электроны от металла.
Кислоты, применяемые в методе вытеснения водорода, обычно выбираются таким образом, чтобы вода, образующаяся в результате реакции, была легко удалена или испарена. Это позволяет получить чистый продукт, состоящий только из растворимого вещества и водорода, который можно легко измерить.
Уравнение реакции позволяет нам рассчитать массу металла, необходимую для выделения определенного количества водорода. Применяя законы сохранения массы и электрического заряда, можно определить молярную массу эквивалента металла и его относительную атомную массу.
Вопрос-ответ

Каким образом метод вытеснения водорода позволяет определить молярную массу эквивалентов металла?
Метод вытеснения водорода основан на реакции между металлом и кислородом воды. При этом металл вытесняет водород из воды, исходя из того, что водород обладает меньшей активностью. Определяя массу вытесненного водорода, можно рассчитать массу металла, который вытеснил водород. Затем, путем простого отношения, рассчитывается молярная масса эквивалентов металла.
Какие дополнительные компоненты и оборудование необходимы для проведения метода вытеснения водорода?
Для проведения метода вытеснения водорода необходимы реакционный сосуд, вода, образец металла, генератор водорода и установка для сбора образовавшегося водорода. Генератор водорода представляет собой устройство для разложения воды на кислород и водород, а установка для сбора водорода позволяет безопасно собирать образующийся газ и измерять его объем.
Каковы основные преимущества и недостатки метода вытеснения водорода?
Основным преимуществом метода вытеснения водорода является его простота и доступность. Кроме того, данный метод позволяет точно определить молярную массу эквивалентов металла. Однако, недостатком данного метода является его энергозатратность, так как для получения водорода требуется электрическая энергия для работы генератора.
Какие металлы можно анализировать с помощью метода вытеснения водорода?
Метод вытеснения водорода можно использовать для анализа различных металлов, таких как железо, медь, алюминий и другие. Однако, этот метод не подходит для анализа неметаллических элементов и тяжелых металлов, так как они не реагируют с водой и водородом.
