Электролиз – это процесс, при котором разложение химического вещества происходит с помощью электрического тока. В химических лабораториях или промышленных процессах электролиз часто используется для производства различных металлических соединений. Один из ключевых вопросов при электролизе – рассчет массы получаемого металла. Для этого необходимо учитывать различные факторы и использовать соответствующие стратегии и методы.
Первым шагом для рассчета массы металла при электролизе является определение величины тока, протекающего через электролит. Ток может быть постоянным или переменным, и его значение может варьироваться в зависимости от условий процесса. Величина тока имеет непосредственное влияние на время электролиза и, следовательно, на массу получаемого металла.
Далее необходимо учитывать молярную массу металла. Молярная масса – это масса одного моля вещества. Она измеряется в граммах на моль и является фундаментальной физической константой. Зная молярную массу металла, можно рассчитать массу одного моля и, соответственно, массу получаемого металла при электролизе.
Рассчет массы металла при электролизе также требует учета степени выхода металла. Степень выхода – это показатель, характеризующий эффективность электролитического процесса и определяющий, сколько металла будет получено в итоге. В реальных условиях процесса степень выхода может быть менее 100%, так как возможны потери энергии в виде тепла или других побочных реакций.
Электролиз: основные понятия и принцип работы

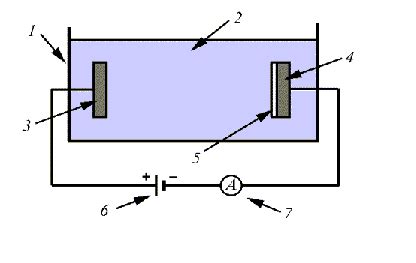
Электролиз - это процесс, в ходе которого при помощи электрического тока происходит разложение соединений на их составные части. Он основан на явлении электролитической диссоциации, когда электролит (вещество, способное проводить электрический ток) разлагается на ионы под действием электрического поля.
Принцип работы электролиза базируется на использовании электролитической ячейки, состоящей из двух электродов, погруженных в электролит. При подключении внешнего источника питания (например, батареи) к электродам, между ними возникает разность потенциалов, и начинается движение зарядов.
Анод - это положительно заряженный электрод, к которому движутся отрицательно заряженные ионы. На аноде происходит окисление ионов (вещества, теряющие электроны), и они переходят в нейтральное состояние. В результате окисления на аноде выделяются электроны, которые передаются внешнему источнику.
Катод - это отрицательно заряженный электрод, к которому двигаются положительно заряженные ионы. На катоде происходит восстановление ионов (вещества, получающие электроны), и они переходят в нейтральное состояние. При этом электроны из внешнего источника передаются на катод.
В результате электролиза происходит разложение электролита на его составные части, которые могут быть собраны вещественные продукты реакции на аноде и на катоде. Масса металла, выделяющегося на катоде, может быть рассчитана с помощью закона Фарадея, который устанавливает пропорциональность между количеством электричества и массой вещества, которое может быть произведено или потреблено в электролизе.
Методы расчета массы металла
Расчет массы металла при электролизе осуществляется с использованием различных методов. Один из основных способов - вычисление массы металла на основе силы тока и времени электролиза. Для этого необходимо знать величину тока (ампер), длительность процесса (в секундах) и мольную массу металла (в г/моль).
Другим методом расчета массы металла является использование эквивалентной электрохимической массы. Эквивалентная электрохимическая масса определяется как масса вещества, соответствующая осаждению или окислению одного эквивалента электричества. Этот метод основан на соотношении между массой металла и количеством электричества, прошедшим через электролит в процессе электролиза.
Также можно применить метод расчета массы металла на основе массы амальгамы. Амальгама - сплав металла с ртутью. Путем измерения массы амальгамы до и после электролиза можно определить массу осажденного металла. Этот метод особенно удобен при работе с металлами, которые с трудом растворяются в электролите или находятся в сложных соединениях.
Существуют и другие методы расчета массы металла при электролизе, такие как использование изменения массы электродов или измерение объема выделившегося газа. Выбор оптимального метода зависит от характеристик и условий проведения электролиза, а также от доступности и точности используемых приборов и аппаратуры.
Метод электролитического эквивалента
Метод электролитического эквивалента является одним из способов определения массы металла, полученного при электролизе. Этот метод основан на законе Фарадея, который утверждает, что количество вещества, которое образуется или растворяется на электроде в результате электролиза, прямо пропорционально количеству электричества, проходящего через электролит.
Для расчета массы металла по методу электролитического эквивалента необходимо знать эквивалентную массу металла, которая равна молярной массе металла, деленной на заряд и коэффициент электролиза. Эквивалентная масса может быть вычислена с использованием таблицы стандартных потенциалов электродов.
Далее необходимо определить количество электричества, прошедшего через электролит, которое можно рассчитать, умножив силу тока на время, в течение которого протекал электролиз. Наконец, чтобы получить массу металла, необходимо умножить количество электричества на эквивалентную массу.
Применение метода электролитического эквивалента позволяет точно определять массу металла, полученного при электролизе, и является важным инструментом в химическом анализе. Этот метод может быть применен для расчета массы различных металлов, включая медь, никель, цинк и другие.
Метод молекулярных масс
Метод молекулярных масс является одним из основных методов для рассчета массы металла при электролизе. Он основан на использовании молекулярных масс веществ. Для расчета массы металла при электролизе необходимо знать состав электролита и знать молекулярные массы его компонентов.
Сначала определяется молекулярная масса электротехнической смеси, которая является суммой молекулярных масс ее компонентов. Затем определяется число электронов, участвующих в реакции при электролизе, и доля металла в электротехнической смеси. Далее, с помощью формулы рассчитывается масса металла, которая равна произведению молекулярной массы смеси, числа электронов и доли металла.
Метод молекулярных масс позволяет рассчитать массу металла при электролизе точно и эффективно. Однако, для его применения необходимо иметь точные данные о составе электролита и молекулярных массах его компонентов. Поэтому перед использованием этого метода необходимо провести анализ и исследование компонентов электролита, чтобы получить достоверные данные для расчета массы металла.
Стратегии рассчета массы металла

Рассчет массы металла при электролизе является важным шагом при проведении данного процесса. Существует несколько стратегий, которые могут быть использованы для определения массы металла.
- Использование формулы: Одной из стратегий является использование соответствующих формул для расчета массы металла. Например, для рассчета массы металла в анодной части электролизера можно использовать формулу, учитывающую силу тока, время электролиза и эквивалентную массу металла.
- Изучение реакционной схемы: Анализ реакционной схемы электролиза может помочь в определении коэффициента переносимости ионов металла. Затем, используя этот коэффициент и количество перенесенных зарядов, можно рассчитать массу металла.
- Учет эффективности электролиза: Стратегия учета эффективности электролиза включает определение коэффициента восстановления металла. На основе этого коэффициента и известной массы иона металла можно рассчитать массу полученного металла.
Как правило, для точного рассчета массы металла при электролизе требуется учет множества факторов, таких как сила тока, время электролиза, коэффициент переносимости ионов и эффективность процесса. Комбинация различных стратегий может позволить достичь наиболее точных результатов.
Использование физических параметров
При рассчете массы металла, полученного при электролизе, можно использовать различные физические параметры, такие как масса металла на аноде, масса металла на катоде, заряд электричества, время проведения электролиза и плотность металла.
Один из способов рассчета массы металла заключается в определении массы металла на аноде и катоде. Для этого используется принцип сохранения массы, согласно которому масса металла на аноде должна быть равна массе металла на катоде. Таким образом, если известна масса металла на аноде или на катоде, можно рассчитать массу металла на другом электроде.
Важным параметром при рассчете массы металла является заряд электричества, который протекает через электролит. Зная значение заряда и известную молярную массу металла, можно определить количество вещества металла, прошедшего через электролит. Затем, умножив количество вещества на молярную массу, можно получить массу металла.
Еще одним практичным методом является использование времени проведения электролиза. Зная заряд электричества и время проведения, можно определить количество затраченной электроэнергии. Зная количество энергии и эффективность электролиза, можно рассчитать массу металла, полученную при данной энергии.
Также можно использовать плотность металла при рассчете его массы. Плотность является физическим параметром, отражающим массу вещества, занимающего определенный объем. Зная объем металла, можно умножить его на плотность и получить массу металла.
Практическая оценка эффективности

Оценка эффективности процесса электролиза металла является важным этапом в исследованиях и производственных процессах в различных областях промышленности. Для проведения такой оценки применяются различные стратегии и методы, которые позволяют получить достоверные результаты.
Одним из распространенных методов оценки эффективности является определение выхода продукта электролиза. Для этого проводится анализ состава раствора, а также измерение объема и массы полученного металла. Такая информация позволяет определить, насколько полно и эффективно происходит процесс электролиза.
Важной составляющей оценки эффективности является также оценка энергетической эффективности процесса. Для этого рассчитывается электрическая энергия, затраченная на проведение электролиза, и сравнивается с полученным металлом. Такой подход позволяет определить, насколько экономически выгоден процесс и какой процент электрической энергии преобразуется в получение металла.
Для улучшения эффективности процесса электролиза также применяются различные стратегии. Например, можно использовать новые катализаторы, оптимизировать параметры процесса, например, температуру, скорость потока раствора и другие факторы. Также можно использовать комбинированные методы, которые позволяют увеличить выход металла при электролизе.
Вопрос-ответ

Какие стратегии можно использовать для расчета массы металла при электролизе?
В расчете массы металла при электролизе можно использовать различные стратегии, включая использование уравнений электродных реакций, закона Фарадея и молекулярных масс веществ.
Каким методом можно рассчитать массу металла, осажденного при электролизе?
Одним из методов расчета массы металла при электролизе является использование стехиометрии электродных реакций, где известны количество переданных электронов и соотношение между количеством электронов и массой металла.
Какие факторы нужно учитывать при расчете массы металла при электролизе?
При расчете массы металла при электролизе необходимо учитывать количество переданных электронов, молекулярные массы веществ, время электролиза и электричество, использующееся для электролиза.
Какова формула для расчета массы осажденного металла при электролизе?
Формула для расчета массы осажденного металла при электролизе можно выразить как количество молей выделившегося металла, умноженное на его атомную массу.
Какой метод эффективнее для расчета массы металла при электролизе: использование закона Фарадея или молекулярных масс веществ?
Оба метода, использование закона Фарадея и молекулярных масс веществ, являются эффективными для расчета массы металла при электролизе, и выбор метода зависит от конкретной ситуации и доступности данных.
