Разложение солей металлов представляет собой процесс химической реакции, в результате которого происходит распад ионов вещества на ионы металла и другие компоненты. Данное явление находит широкое применение в различных областях науки и промышленности, от металлургии до медицины.
Основными механизмами разложения солей металлов являются термическое разложение, электролиз и химические реакции. Термическое разложение происходит при нагревании соли до определенной температуры, что приводит к выделению газов и образованию оксидов металла. Электролиз основан на пропускании электрического тока через раствор соли металла, что приводит к разделению ионов и осаждению металла на электроде. Химические реакции включают реагирование соли металла с другими веществами, например, кислотами или основаниями, что приводит к выделению осадка или образованию нового соединения.
Применение процесса разложения солей металлов находится повсеместно в промышленности. Он используется для получения металлов из их солей, очистки растворов от ионов металлов, отделения компонентов в химических процессах и создания новых материалов. Кроме того, разложение солей металлов играет важную роль в процессах выделения и очистки металлов при переработке руд и отходов промышленности.
Что такое разложение солей металлов?

Разложение солей металлов – это химическая реакция, в результате которой происходит распад соединений металлов на их ионы при нагревании или взаимодействии с другими веществами. Этот процесс имеет особое значение в различных областях науки и промышленности.
Разложение солей металлов может происходить как при простом нагревании, так и при взаимодействии с кислотами или другими химическими веществами. В результате данной реакции металлические ионы выделяются наружу, образуя осадок или тонкую металлическую пленку на поверхности другого вещества - носителя.
Разложение солей металлов имеет широкое применение в научных исследованиях и технических процессах. Например, это может быть использовано для получения металлических пленок на различных материалах, таких как стекло, керамика или пластик. Такие покрытия обладают различными свойствами, такими как проводимость электричества или защита от коррозии, и могут быть использованы в электронике, оптике, медицине и других отраслях.
Кроме того, разложение солей металлов является важным процессом для получения качественных аналитических данных в химическом анализе. Этот метод позволяет определить содержание металлов в различных образцах и используется в аналитической химии, экологии и других научных дисциплинах.
Разложение солей металлов – это процесс, в результате которого происходит распад сложных соединений металлов на более простые компоненты.
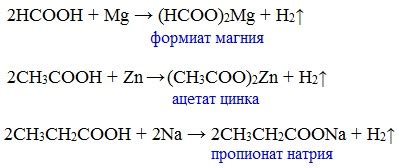
При разложении солей металлов происходит разрушение кристальной решетки соединения, катализируемое повышенной температурой, химическими реагентами или электрическим током. В результате разложения образуются металлические и неметаллические ионы, а также молекулярные или неорганические соединения.
Одним из примеров разложения солей металлов является электролиз, при котором электрический ток приводит к распаду ионов солей на аноде и катоде. Например, при электролизе серной кислоты в растворе образуется кислород на аноде и водород на катоде.
Разложение солей металлов является важным процессом с точки зрения применения в различных отраслях промышленности. Например, при производстве алюминия из руды происходит разложение солей алюминия, что позволяет получать металл в чистом виде. Кроме того, разложение солей металлов может использоваться для получения различных пигментов, катализаторов, фосфорных удобрений и других продуктов.
В зависимости от условий и реагентов, используемых при разложении солей металлов, процесс может проходить с различной степенью интенсивности и образованием различных продуктов разложения. Правильное понимание и контроль этих процессов позволяет эффективно использовать разложение солей металлов в различных областях науки и техники.
Механизмы разложения солей металлов
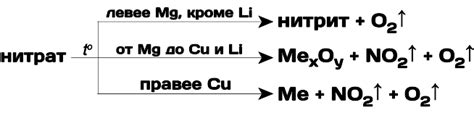
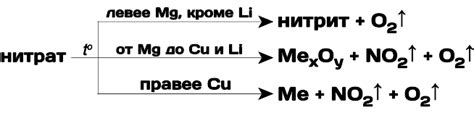
1. Термическое разложение: Одной из основных причин разложения солей металлов является их нагревание. Под воздействием высокой температуры и энергии происходит распад солей на ионы металла и противоионы. Этот процесс часто применяется в металлургической промышленности для получения металлов из их руд или для разложения солей при производстве электролитов.
2. Электролитическое разложение: Ионы металла в растворе под действием электрического тока могут мигрировать к электродам, образуя на них осадок или производя газы. Этот метод широко используется в электрохимической промышленности для получения металлов, очистки сточных вод и других целей.
3. Химическое разложение: Соли металлов могут разлагаться под влиянием реагентов, которые изменяют структуру солей или связь между ионами. Например, разложение гидроксида меди (II) при воздействии сильных кислот основывается на образовании растворимых солей и сильной жидкости.
4. Фотолиз: Некоторые соли металлов разлагаются под воздействием света. Фотолиз приводит к образованию радикалов и молекул с высокой активностью, что способствует разложению солей. Этот процесс в основном используется в фотохимических реакциях и производстве фоточувствительных материалов.
5. Рентгенолиз: Рентгенолиз применяется для разложения сложных солей металлов, при котором рентгеновские лучи с высокой энергией вызывают разрушение молекул вещества. Этот метод широко используется в медицине для модификации структуры белков и в химических исследованиях для изучения свойств молекул.
Как происходит разложение?

Разложение солей металлов - это процесс, в ходе которого ионы металла выделяются из раствора и образуют новые соединения. Данный процесс может происходить спонтанно или при воздействии различных физических или химических факторов.
Спонтанное разложение солей металлов чаще всего связано с их нестабильностью в конкретных условиях. Например, некоторые соли металлов могут разлагаться при повышенной температуре или при воздействии света. В таких случаях ионы металла оседают на поверхности раствора или образуют нерастворимые осадки.
Кроме того, разложение солей металлов может быть стимулировано химическими реакциями. Например, при взаимодействии с другими соединениями в растворе или при добавлении реактивов происходит образование новых веществ, оседание осадка или выделение газа.
Применение разложения солей металлов нашло широкое применение в различных областях. Например, в химическом анализе это явление используется для определения содержания определенного металла в образце. Также разложение солей металлов применяется в технологических процессах, например, для получения металлического порошка или извлечения ценных металлов из руды.
Практическое применение разложения солей металлов

Разложение солей металлов имеет широкое практическое применение в разных областях, таких как химическая, фармацевтическая, электронная и другие отрасли промышленности. С помощью этого процесса можно получить металлические соединения, которые имеют важное значение для производства различных продуктов.
Одной из основных областей применения разложения солей металлов является химическая промышленность. С помощью этого процесса можно получить металлы высокой чистоты, которые необходимы для производства различных химических соединений. Например, медь, полученная из разложения соли меди, используется в производстве электрических проводов, медицинского оборудования и других химических изделий.
Фармацевтическая промышленность также активно использует разложение солей металлов. Например, разложение солей железа позволяет получить частицы железа, которые используются для производства препаратов, направленных на лечение анемии и других заболеваний. Также разложение солей цинка используется в производстве солнцезащитных средств и косметики.
В электронной промышленности разложение солей металлов играет важную роль при получении металлических контактов для полупроводниковых приборов. С помощью этого процесса можно получить высокочистые металлические слои, которые обладают отличными электрофизическими свойствами. Это особенно важно для производства микроэлектроники и сенсорных устройств.
Таким образом, разложение солей металлов является важным процессом, который находит применение в различных отраслях промышленности. Благодаря этому процессу можно получить высококачественные металлические соединения, которые играют важную роль в производстве различных продуктов и технологий.
Где может быть использовано разложение?

Разложение солей металлов является важным процессом и находит широкое применение в различных областях науки и технологий.
В химической промышленности разложение солей металлов используется для получения чистых металлов. Этот процесс позволяет извлечь металлы из их руд и использовать их для производства различных изделий и материалов. Также разложение солей используется в процессе электродного осаждения, где происходит отделение металла от его раствора при помощи электрического тока.
В аналитической химии разложение солей металлов используется для определения и выделения определенных металлов. Данный процесс позволяет провести качественный и количественный анализ присутствующих металлов в образце.
В биологических и медицинских исследованиях разложение солей металлов находит применение в процессе обработки проб, таких как ткани, кровь и моча, для получения информации о содержании металлов в организмах людей и животных. Это позволяет выявить наличие тяжелых металлов и определить их вредное воздействие на здоровье.
Также разложение солей металлов используется в процессе производства химических удобрений. Металлические соли превращаются в питательные элементы, которые усваиваются растениями и способствуют их росту и развитию.
Преимущества разложения солей металлов
Разложение солей металлов – это процесс химической реакции, в результате которой происходит распад соли на металлический катион и анион. Такой процесс имеет ряд преимуществ, которые делают его полезным и широко применимым.
1. Получение металлических элементов: Разложение солей металлов позволяет получать металлические элементы в чистом виде. Это особенно важно в производстве различных изделий, электроники и других промышленных отраслях, где требуется использование металлов высокой чистоты.
2. Экономия сырья и энергии: Разложение солей металлов позволяет эффективно использовать сырье. В основе процесса лежит восстановление металлов из солей, что позволяет сэкономить энергию и снизить затраты на добычу и переработку природных ископаемых.
3. Контролируемая процесс: Разложение солей металлов позволяет контролировать степень чистоты получаемого металла и его свойства. Оптимизация процесса позволяет получать металл с желаемыми характеристиками, что важно в разработке новых материалов и специализированных изделий.
4. Возможность переработки отходов: Разложение солей металлов может быть использовано для переработки отходов, содержащих металлы. Это позволяет снизить негативное влияние на окружающую среду и получить ценные ресурсы из отходов, тем самым способствуя устойчивому развитию.
5. Разнообразие применений: Процесс разложения солей металлов находит применение в различных отраслях, таких как электроника, производство аккумуляторов, катализаторы и другие. Возможность получения металлов высокой чистоты с определенными свойствами позволяет создавать новые материалы и технологии.
Вопрос-ответ

Какие механизмы происходят при разложении солей металлов?
При разложении солей металлов могут происходить различные механизмы, в зависимости от типа соли и условий реакции. Одним из основных механизмов является термическое разложение, при котором соль распадается на металл и кислород. Иногда могут происходить и другие типы реакций, например, гидролиз, при котором соль разлагается под действием воды на кислоту и основание.
Какие сферы применения имеет процесс разложения солей металлов?
Процесс разложения солей металлов широко используется в различных сферах. Например, в металлургии разложение солей металлов позволяет получать металлические элементы из их солей. В химической промышленности разложение солей используется для получения различных продуктов, таких как кислоты и основания. Кроме того, процесс разложения солей металлов имеет также применение в лабораторных исследованиях и синтезе новых веществ.
