В химии, щелочи являются одним из основных классов химических соединений. Они являются оксидами металлов, образующимися в результате реакции металла с водой. Щелочи широко используются в различных отраслях промышленности, а также в бытовых условиях.
Получение щелочей из металлов и воды основано на реакции активных металлов с водой. Во время этой реакции между металлом и водой происходит выделение водорода и образование щелочи. Данная реакция является экзотермической, то есть выделяет тепло.
Реакция металла с водой происходит следующим образом: вода активно взаимодействует с поверхностью металла, и на месте контакта между ними образуется оксид металла, который в свою очередь реагирует с водой и образует щелочь и водород. Образовавшаяся щелочь — это основное соединение, состоящее из ионов металла и гидроксильных ионов.
Например, реакция между натрием (Na) и водой (H₂O) приводит к образованию щелочи натрия (NaOH) и выделению водорода (H₂). Эта реакция происходит по следующей схеме:
2 Na + 2 H₂O → 2 NaOH + H₂
Таким образом, получение щелочи из металлов и воды является важным процессом, который используется в промышленности и на бытовом уровне. Полученная щелочь может быть использована в производстве мыла, стекла, бытовой химии и других применениях.
Химическая реакция: получение щелочи из металлов и воды
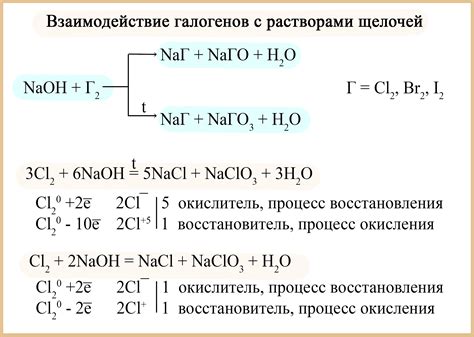
Химическая реакция, позволяющая получить щелочи из металлов и воды, основана на реакции между металлами и водой. Металлы реагируют с водой, образуя щелочи и выделяя водород. Этот процесс называется щелочным гидролизом.
Один из примеров такой реакции является реакция натрия с водой. При контакте натрия с водой происходит быстрое образование гидроксида натрия и выделение водорода:
2Na + 2H2O -> 2NaOH + H2
Полученный гидроксид натрия является щелочью и широко используется в разных отраслях, например, в бытовой химии, стекловидных производствах и других.
Также можно получить щелочь из других металлов, например, из калия, лития, рубидия. Реакция этих металлов с водой протекает аналогично и приводит к образованию соответствующих гидроксидов.
Для проведения реакции необходимо использовать активные металлы, так как они обладают достаточно высокой электроотрицательностью, чтобы разлагать молекулы воды. Неактивные металлы, такие как железо или цинк, обычно не реагируют с водой, и поэтому не идеальны для получения щелочей.
Реакция щелочей с водой
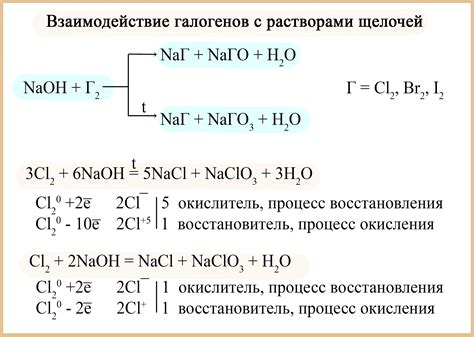
Щелочи – это химические вещества, обладающие выраженными щелочными свойствами. Они растворяются в воде, образуя щелочные растворы. Реакция щелочей с водой является примером щелочного гидролиза.
Когда щелочные вещества взаимодействуют с водой, происходит реакция образования щелочного раствора. В процессе реакции происходит ионизация щелочи, то есть образование ионов гидроксида и соответствующего катиона. Например, реакция натрия с водой дает гидроксид натрия и молекулы воды.
Реакция щелочей с водой обладает выраженной экзотермичностью, то есть выделяется большое количество тепла. Это связано с тем, что реакция сопровождается энергетическими изменениями, связанными с образованием новых химических связей.
Имеющиеся данные позволяют сравнить реактивность различных щелочей с водой. Например, натрий реагирует очень быстро и ярко с выделением газа и пламени. Калий проявляет еще большую реактивность – он раскаливается, образуя огонь и выделяя водородный газ. В целом реакция щелочей с водой является очень важным процессом, который широко используется в химической промышленности.
Металлические щелочи и их свойства
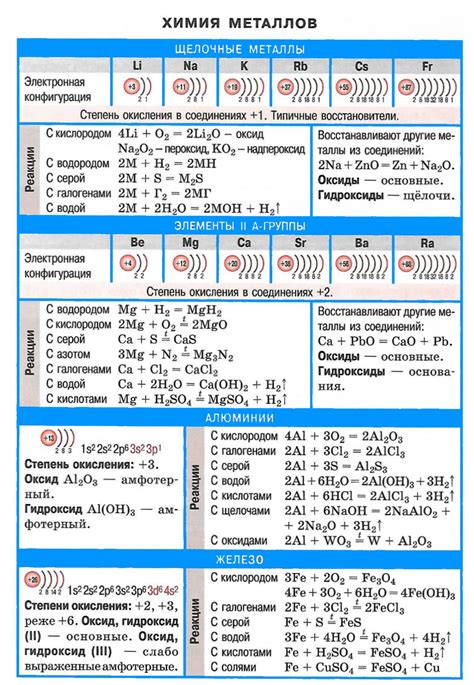
Металлические щелочи являются основными веществами, их химическое название – гидроксиды. Гидроксиды щелочных металлов широко используются в промышленности и в быту. Они обладают рядом характерных свойств, которые делают их ценными и полезными веществами.
Первое свойство металлических щелочей – базичность. Их растворы при взаимодействии с водой образуют гидроксиды, которые обладают щелочной реакцией и могут нейтрализовать кислоты. Благодаря этому свойству металлические щелочи широко применяются в химической промышленности для производства кислот и солей.
Второе свойство металлических щелочей – растворимость. Гидроксиды щелочных металлов хорошо растворяются в воде, образуя насыщенные растворы. Это свойство позволяет использовать металлические щелочи для приготовления растворов различной концентрации и использовать их в лаборатории и промышленности.
Третье свойство металлических щелочей – щелочной окислительный потенциал. Гидроксиды щелочных металлов способны окислять другие вещества, давая электроны и самостоятельно превращаясь в окислитель. Это свойство делает металлические щелочи важными химическими реагентами в процессе получения различных соединений.
Методы получения щелочей

Щелочи - это химические соединения, которые широко используются в различных отраслях промышленности и быту. Существует несколько методов получения щелочей, включая электролиз, реакцию металлов с водой и химические превращения.
Один из методов получения щелочей - это электролиз растворов солей щелочных металлов. Этот процесс основан на применении электрического тока, который разлагает соли, содержащие ионы щелочных металлов. В результате электролиза образуются щелочи и свободные газы.
Еще одним методом получения щелочей является реакция металлов с водой. Некоторые щелочные металлы, такие как калий и натрий, реагируют с водой, образуя гидроксиды и высвобождая водород. Реакция металлов с водой может быть экономичным и эффективным способом получения щелочей.
Кроме того, щелочи могут быть получены путем химических превращений. Например, гидроксид натрия можно получить путем щелочной нейтрализации газообразной соды и раствора серной кислоты. Также щелочи могут быть получены путем термического разложения нитратов щелочных металлов.
Важно отметить, что выбор метода получения щелочей зависит от конкретной задачи и требований процесса. Каждый метод имеет свои преимущества и недостатки, поэтому необходимо выбирать наиболее подходящий способ, учитывая конкретные условия и цели производства щелочей.
Химическая реакция щелочей с металлами
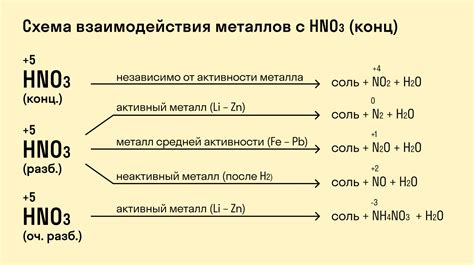
Щелочи - это растворимые основания, состоящие из гидроксидов щелочных металлов. Они обладают щелочным вкусом, способны изменить окраску индикаторов и часто используются в бытовых и промышленных целях.
Когда щелочь вступает в реакцию с металлом, происходит окислительно-восстановительная реакция. Металл отдает электроны, образуя положительные ионы, а гидроксид щелочи принимает эти электроны, образуя отрицательные ионы.
Реакция щелочи с металлами может проходить с выделением водорода и образованием гидроксида металла. Например, реакция между натрием и водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода (H2).
Также реакция щелочей с металлами может сопровождаться образованием солей. Например, реакция между гидроксидом калия (KOH) и алюминием (Al) приводит к образованию соли калия и алюминия (KAl(SO4)2).
Щелочные металлы, такие как натрий, калий и литий, обладают более активными свойствами и легче реагируют с водой и другими веществами. Это делает их важными компонентами в различных отраслях промышленности и научных исследований.
Применение щелочей в промышленности

Щелочи, получаемые из металлов и воды, нашли широкое применение в различных отраслях промышленности благодаря своим уникальным свойствам.
В первую очередь, щелочи активно используются в производстве стекла. Процесс создания стекла основан на химической реакции между щелочами, кремнием и различными добавками. Щелочи играют роль расплавляющего агента, благодаря которому сырье переходит в текучее состояние и может быть легко формовано и стеклообразовано. Они также влияют на химические и оптические свойства готового стекла.
Щелочи также применяются в производстве бытовых и промышленных моющих средств. Благодаря своей щелочной природе, они обладают высокой моющей способностью и хорошо справляются с удалением жиров, пятен и загрязнений. Щелочные моющие средства широко используются в прачечных, гостиничном бизнесе, промышленных предприятиях, а также в домашнем хозяйстве.
Необходимо отметить, что щелочи играют важную роль в промышленности, связанной с производством бумаги. Бумага изготавливается из дерева или целлюлозы, и для разложения этих материалов используется процесс щелочного варения. В результате этого процесса, вещества, содержащиеся в дереве или целлюлозе, растворяются в щелочной среде, что позволяет выделить чистую целлюлозу для производства бумаги.
Также щелочи широко используются в обработке металлов и производстве металлоконструкций. Они применяются для очистки и удаления оксидной пленки с поверхности металла, а также для подготовки металла к последующим операциям обработки и нанесению защитного слоя. Щелочи помогают предотвратить коррозию и улучшить прочность и внешний вид металлических изделий.
Области применения щелочей в быту
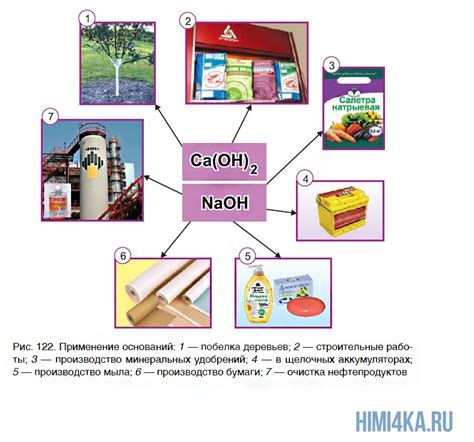
Щелочи, полученные из металлов и воды, находят широкое применение в быту. Они являются неотъемлемыми компонентами многих бытовых химических продуктов.
1. Уборка и чистка: Щелочные растворы, такие как мыльная вода, являются одним из самых распространенных средств для уборки и чистки поверхностей. Они эффективно удаляют жир, грязь и пятна, делая поверхности чистыми и блестящими.
2. Личная гигиена: Щелочи, такие как щелочное мыло или шампунь, широко используются для поддержания гигиены тела. Они помогают эффективно очищать кожу и волосы, удаляя излишки жира, пыли и других загрязняющих веществ.
3. Производство пищевых продуктов: Щелочные растворы, такие как пищевая сода или пекарский порошок, используются в кулинарии для приготовления различных блюд. Они могут использоваться для регулирования pH продуктов, позволяя достичь необходимой консистенции или текстуры.
4. Приготовление напитков: Щелочные растворы, такие как содовая вода, широко используются для приготовления прохладительных напитков. Они придают напитку газированный эффект и освежающий вкус.
5. Фермерство и садоводство: Щелочи используются в сельском хозяйстве и садоводстве для регулирования pH почвы и воды. Они помогают достичь оптимальных условий для роста растений и увеличения урожайности.
6. Производство моющих средств: Щелочные растворы, такие как натр, являются важными компонентами производства моющих средств. Они обладают моющими и отжирающими свойствами, которые помогают эффективно удалять загрязнения из различных поверхностей.
Безопасность химических реакций с щелочями

Химические реакции, связанные с получением щелочей из металлов и воды, требуют особой осторожности и соблюдения мер безопасности.
Первое, что необходимо помнить, это то, что при этом типе реакций выделяется большое количество газа. Избегайте проведения экспериментов в закрытых помещениях без хорошей вентиляции.
Также следует помнить, что щелочи имеют высокий уровень щелочности, поэтому при работе с ними необходимо использовать специальные средства индивидуальной защиты, такие как рукавицы и защитные очки.
При работе с щелочами необходимо проявлять крайнюю осторожность. Одно некорректное движение или неправильное сочетание реагентов может привести к опасным последствиям. Поэтому рекомендуется проводить такие эксперименты только под руководством опытного специалиста.
В случае аварийной ситуации необходимо незамедлительно обратиться за медицинской помощью. Также необходимо запомнить номер экстренной службы.
Влияние щелочей на окружающую среду

Щелочи, производимые в результате химических реакций между металлами и водой, могут иметь значительное влияние на окружающую среду. Они являются высоко щелочными веществами, которые могут вызывать различные нежелательные эффекты на биологическую и экологическую системы.
В первую очередь, высокая щелочность может привести к загрязнению водных систем. Щелочи, попадая в реки, озера или другие водоемы, могут изменять естественный показатель pH и нарушать химическое равновесие. Это может оказывать вредные последствия для рыб, водных растений и других организмов, живущих в воде.
Щелочи также могут наносить ущерб почве. Если щелочи попадают на почву, они могут вызывать образование щелочного слоя, что в свою очередь может снизить плодородие почвы или сделать ее непригодной для сельского хозяйства. Кроме того, высокий уровень щелочности может оказывать негативное влияние на микроорганизмы, которые обеспечивают гумусообразование и декомпозицию органических веществ.
Воздействие щелочей на растительный покров также следует учесть. Высокая щелочность может вызывать хлороз и другие заболевания у растений, что может привести к повреждению или гибели их. Растения, как важный компонент экосистемы, могут стать уязвимыми к изменениям в окружающей среде и вмешательству человека при нарушении нормального химического баланса.
Итак, действие щелочей на окружающую среду является достаточно серьезной проблемой, требующей постоянного мониторинга и контроля. Правильное управление окружающей средой и применение технологий очистки и нейтрализации щелочей могут помочь минимизировать негативное влияние этих веществ и сохранить экологическую устойчивость важных природных систем.
Вопрос-ответ

Какие металлы используют для получения щелочей?
Для получения щелочей чаще всего используют такие металлы, как натрий и калий. Они реагируют с водой, образуя гидроксиды - основания, которые и называют щелочами.
Как происходит химическая реакция при получении щелочей?
Химическая реакция при получении щелочей происходит между металлом и водой. Металл реагирует с водой, образуя гидроксид металла и выделяя водород. Также в результате реакции образуется тепло.
Какие свойства имеют щелочи?
Щелочи обладают рядом характерных свойств. Они имеют щелочную реакцию, то есть обладают высоким значениям pH (больше 7). Кроме того, щелочи растворяются в воде, дают электролитические растворы, способствуют гидролизу солей и образуют такие химические соединения, как соли орто- и пиро-щелочные.
