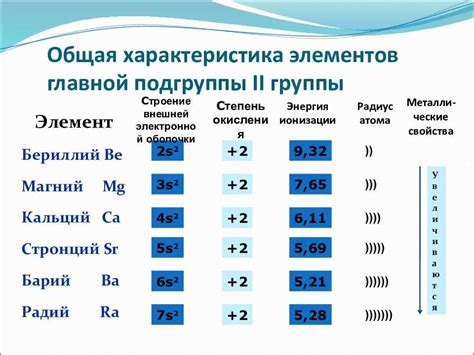
Щелочноземельные металлы - это элементы второй группы периодической таблицы, включающие бериллий, магний, кальций, стронций, барий и радий. Их химические свойства делают их полезными в различных сферах, от промышленности до медицины. Однако получение этих металлов может быть сложным процессом, требующим применения специальных методов и реакций.
Одним из основных способов получения щелочноземельных металлов является электролиз. В этом процессе исследуемую соль или расплав щелочноземельного металла помещают в электролитическую ячейку и подвергают воздействию электрического тока. Электролиз позволяет разложить соль или расплав на положительные и отрицательные ионы и отделить металл от остальных компонентов. Например, для получения магния на начальной стадии электролиза применяют магниевый оксид или магниевые соли.
Другим способом получения щелочноземельных металлов является метод восстановления. В этом методе вещество-прекурсор, обычно металлический оксид или соль, подвергается реакции с веществом, обладающим сильным восстановительным действием, например, с железом или алюминием. При этом происходит окислительно-восстановительная реакция, в результате которой металл переходит в ионное состояние и затем обратно осаждается в виде чистого металла. С помощью этого метода можно получить кальций из кальциевого оксида - распространенной подстили оксида в щелочноземельных металлах.
Электролиз солей щелочноземельных металлов

Электролиз солей щелочноземельных металлов – это один из способов получения щелочноземельных металлов, таких как магний, кальций, стронций и барий. Он основан на использовании электрического тока для разложения солей данных металлов на их элементы.
В процессе электролиза соли щелочноземельных металлов растворяются в специальной электролите, который содержит ионы металла и свободные движущиеся ионы. Затем приложенный электрический ток приводит к разделению ионов и осуществляет процесс электролиза.
В результате электролиза происходит отделение щелочноземельных металлов от ионов их солей. В катодной части электролизной ячейки металлы восстанавливаются из раствора на электроде при подаче отрицательного электрического заряда. Анодная часть электролизной ячейки, напротив, играет роль источника положительных ионов, которые перемещаются к катоду и участвуют в реакции.
Электролиз солей щелочноземельных металлов является эффективным методом получения данных металлов с высокой чистотой. Этот процесс широко применяется в промышленности для производства щелочноземельных металлов и их соединений, которые находят применение в различных отраслях, включая металлургию, строительство и химическую промышленность.
Термическое восстановление оксидов щелочноземельных металлов
Термическое восстановление оксидов щелочноземельных металлов является одним из способов получения данных металлов. Процесс основан на использовании высоких температур, которые позволяют превратить оксиды в чистые металлы.
Для проведения термического восстановления оксидов щелочноземельных металлов необходимо подвергнуть их нагреванию в высокотемпературной печи. Оксиды при этом подвергаются реакции с углеродом или водородом, в результате чего образуются щелочноземельные металлы и соответствующие оксиды углерода или воды.
Реакция термического восстановления происходит в инертной атмосфере, чтобы избежать окисления металлов. Выбор атмосферы зависит от конкретного оксида металла и требуемого результата. Например, для восстановления оксида магния (MgO) используют атмосферу азота или аргона, чтобы предотвратить его окисление.
Термическое восстановление оксидов щелочноземельных металлов является важным процессом для получения чистых и высококачественных металлов. Он находит применение в различных отраслях промышленности, включая производство сплавов, электронику, медицину и другие. Этот метод имеет множество преимуществ, таких как эффективность, экономичность и возможность получить металлы с высокой степенью очистки.
Функциональное применение магния в процессе получения щелочноземельных металлов

Магний является одним из основных элементов, используемых в процессе получения щелочноземельных металлов. Его функциональное применение связано с его уникальными химическими свойствами и возможностью реагировать с другими веществами.
Магний активно применяется в процессе электролиза, который используется для получения щелочноземельных металлов. В этом процессе магний выступает как катод и играет важную роль в электрохимической реакции. Он позволяет снизить энергозатраты на производство щелочноземельных металлов и повысить эффективность процесса.
Кроме того, магний обладает высокой теплопроводностью и низкой плотностью, что делает его идеальным материалом для производства электролитических катализаторов. Это позволяет использовать магний в процессе получения щелочноземельных металлов для повышения скорости и эффективности реакций.
Функциональное применение магния в процессе получения щелочноземельных металлов также связано с его способностью образовывать стабильные сплавы с другими металлами. Это позволяет улучшить физические и химические свойства получаемых металлов и снизить их стоимость.
Таким образом, магний играет ключевую роль в процессе получения щелочноземельных металлов благодаря своим уникальным химическим свойствам и возможности взаимодействовать с другими веществами. Применение магния позволяет снизить энергозатраты, повысить скорость и эффективность реакций, а также улучшить свойства получаемых металлов.
Получение бериллия через реакцию сульфата щелочноземельных металлов с гидроксидом аммония

Бериллий является щелочноземельным металлом, который широко используется в различных отраслях промышленности, таких как электроника, аэрокосмическая промышленность и ядерная энергетика. Он имеет высокую прочность, жаропрочность и химическую стабильность, что делает его идеальным материалом для производства различных компонентов.
Один из способов получения бериллия состоит в реакции сульфата щелочноземельных металлов с гидроксидом аммония. Для этой реакции используются соединения магния, кальция или стронция и аммонийгидроксид, которые являются доступными и дешевыми реагентами.
Реакция проходит следующим образом: вначале сульфат щелочноземельного металла растворяется в воде, образуя соответствующую соль. Затем в этот раствор добавляется гидроксид аммония, что приводит к образованию осадка бериллиевого гидроксида. Осадок затем выделяется и промывается, чтобы удалить остатки реагентов и другие примеси.
Полученный бериллиевый гидроксид может быть дальше превращен в другие соединения на основе бериллия или использован для производства различных материалов. Этот метод является одним из наиболее эффективных и доступных способов получения бериллия и широко применяется в промышленности.
Действие метастабильности на гидролиз солей щелочноземельных металлов
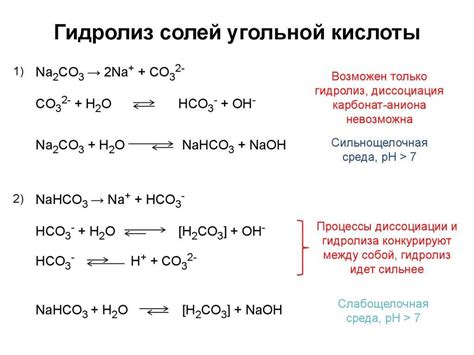
Метастабильность солей щелочноземельных металлов, таких как магний, кальций и стронций, может оказывать влияние на процесс гидролиза.
Гидролиз - это процесс расщепления солей на ионы с помощью воды. При гидролизе солей щелочноземельных металлов ионы металлов реагируют с водой, образуя гидроксиды и ионы водорода. Метастабильность некоторых солей может изменять скорость и степень гидролиза.
Магниевые соли обычно демонстрируют низкую скорость гидролиза, хотя некоторые из них, такие как сульфат магния, могут образовывать незначительные количества гидроксида магния при растворении в воде.
Соли кальция и стронция, напротив, могут проявлять высокую степень гидролиза. Например, сульфаты кальция и стронция взаимодействуют с водой, образуя гидроксиды и сульфоводородные ионы. Это объясняется тем, что соли щелочноземельных металлов обладают достаточной кислотностью и метастабильностью для активного участия в гидролизе.
Важно отметить, что процесс гидролиза может быть ослаблен или усилен в зависимости от условий реакции. Факторы, такие как концентрация соли, pH раствора и температура, могут влиять на степень гидролиза солей щелочноземельных металлов.
В целом, действие метастабильности на гидролиз солей щелочноземельных металлов играет важную роль в химических реакциях, влияя на скорость и направление реакции гидролиза и образования гидроксидов металлов.
Способы получения земляного щелочноземельного металла

Щелочноземельные металлы - это группа химических элементов в периодической системе, включающая бериллий, магний, кальций, стронций, барий и радий. Они характеризуются высокой реактивностью и электроотрицательностью, что делает их важными в различных промышленных процессах.
Существует несколько способов получения земляного щелочноземельного металла, включая:
- Электролиз. Данный способ основан на применении электрического тока для разложения соединения металла на его составляющие. Металл получается на катоде, а на аноде образуются продукты окисления.
- Термическое восстановление. В этом случае металл получают путем разложения его соединений при высокой температуре. Обычно используется восстановление хлорида или оксида металла.
- Лужение раствором карбида. Этот способ основан на реакции металлического карбида с щелочным раствором, в результате которой образуется щелочноземельный металл.
- Пирохимический метод. Он заключается в обработке оксида металла алюминием при высоких температурах и вакууме. В результате этого процесса происходит образование земляного щелочноземельного металла.
Каждый из этих способов обладает своими преимуществами и недостатками, и выбор определенного метода зависит от конкретных условий и требований производства.
Кислотное выщелачивание оксидов щелочноземельных металлов

Кислотное выщелачивание оксидов щелочноземельных металлов является одним из способов получения этих металлов. При этом процессе применяются различные кислоты, такие как серная, соляная или солянокислотная.
Оксиды щелочноземельных металлов, такие как оксид кальция (известный как известь), оксид магния (известный как магнезия), оксид бария (известный как барит), содержатся в природных рудах. Чтобы получить металлы, эти оксиды требуется превратить в соответствующие соли, и кислотное выщелачивание помогает в этом.
Процесс начинается с освобождения оксида металла из руды. Затем, оксид погружается в кислоту, и происходит реакция, в результате которой оксид превращается в соль. Эта реакция часто сопровождается выделением газа, такого как углекислый газ.
Оксиды щелочноземельных металлов широко используются в различных отраслях промышленности. Например, оксид кальция используется в строительстве, в производстве цемента и стекла. Оксид магния применяется в производстве огнеупорных материалов, и в медицине в качестве гастропротектора. Оксид бария используется в производстве телевизионных экранов и стекольных изделий.
Таким образом, кислотное выщелачивание оксидов щелочноземельных металлов является эффективным способом получения этих металлов из руд и играет важную роль в промышленности.
Вопрос-ответ

Какие существуют способы получения щелочноземельных металлов?
Существуют различные способы получения щелочноземельных металлов, таких как электролиз или восстановление соединений металлов.
Как происходит получение щелочноземельных металлов электролизом?
При получении щелочноземельных металлов электролизом используется технология расплавного электролиза, при которой соединение металла плавится и становится проводником электричества. Затем через соединение пропускают постоянный электрический ток, в результате чего происходит процесс диссоциации и получения металлического металла.
Что такое восстановление соединений металлов?
Восстановление соединений металлов - это химический процесс, в результате которого вещества с более высокими степенями окисления переходят в соединения с более низкими степенями окисления. В случае щелочноземельных металлов, это означает превращение оксидов или гидроксидов в металлические формы.
Какая реакция может быть использована для получения щелочноземельных металлов?
Одной из реакций, которая может быть использована для получения щелочноземельных металлов, является реакция восстановления с помощью металлов как восстановителей. Например, магний может быть использован для восстановления оксидов или гидроксидов щелочноземельных металлов.
