Химические элементы могут быть разделены на две основные группы: металлы и неметаллы. И хотя все элементы имеют свои уникальные химические свойства, атомы металлов и неметаллов обладают определенными отличиями.
Атомы металлов обычно отличаются от атомов неметаллов по нескольким основным характеристикам. Во-первых, атомы металлов имеют меньшую электроотрицательность. Это означает, что атомы металлов имеют склонность отдавать электроны в реакциях с другими элементами. Второе отличие заключается в том, что атомы металлов обладают большими размерами и сложной структурой, что позволяет им образовывать ионы с положительным зарядом.
С другой стороны, атомы неметаллов обычно обладают большей электроотрицательностью. Это означает, что атомы неметаллов имеют склонность принимать электроны от других элементов в реакциях. Кроме того, атомы неметаллов обычно имеют меньшие размеры и простую структуру, что позволяет им образовывать ионы с отрицательным зарядом.
Таким образом, отличия в химических свойствах между атомами металлов и неметаллов в значительной степени связаны с разницей в их электроотрицательности, размерах и структуре атомов. Эти отличия играют важную роль в химических реакциях и образовании соединений элементов различных групп.
Определение атома металла

Атом металла - это минимальная однородная частица металла, сохраняющая его химические и физические свойства. Металлы представляют собой группу химических элементов, обладающих определенными характеристиками, которые определяются их атомным строением.
Атомы металлов имеют ряд особенностей, которые различают их от атомов неметаллов. Во-первых, атомы металлов обладают низкой электроотталкивающей силой между своими электронами, что позволяет им образовывать металлические связи и образовывать металлическую решетку. Во-вторых, атомы металлов имеют относительно больший радиус по сравнению с атомами неметаллов, что связано с наличием большего числа электронов в их внешней энергетической оболочке. В-третьих, атомы металлов могут вступать в химические реакции, отдавая свои внешние электроны, что обусловливает их ионный характер.
Основные свойства атомов металлов, такие как металлический блеск, тепло- и электропроводность, мягкость, пластичность, их способность образовывать сплавы и амальгамы, определяются их атомной структурой. Атомы металлов образуют металлическую решетку, в которой атомы объединены между собой свободными электронами. Это обеспечивает уникальные физические и химические свойства металлов, такие как высокая тепло- и электропроводность, хорошая пластичность и деформируемость.
| Свойство | Атомы металлов | Атомы неметаллов |
|---|---|---|
| Электроотталкивающая сила | Низкая | Высокая |
| Радиус | Большой | Маленький |
| Точка плавления | Высокая | Низкая |
| Теплопроводность | Высокая | Низкая |
| Электропроводность | Высокая | Низкая |
В заключение, атомы металлов обладают определенными химическими и физическими свойствами, которые отличают их от атомов неметаллов. Атом металла представляет собой минимальную единицу металла, которая сохраняет его характеристики. Понимание атомной структуры металлов позволяет лучше понять и объяснить их уникальные свойства и поведение в химических реакциях.
Структура атома металла
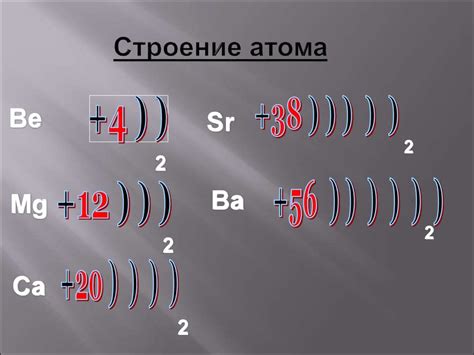
Металл представляет собой химический элемент, который, в отличие от неметаллов, обладает определенными свойствами структуры атома.
Атом металла состоит из ядра, вокруг которого движутся электроны. Ядро атома металла содержит протоны, которые обладают положительным зарядом, и нейтроны, обладающие нейтральным зарядом. Протоны находятся в центре ядра, а нейтроны находятся рядом с протонами.
Одной из особенностей атома металла является его электронная оболочка. Данная оболочка включает в себя электроны, которые движутся по определенным орбитам вокруг ядра. Количество электронов в атоме металла определяет его электронную конфигурацию.
Обычно атомы металлов имеют несколько электронных оболочек, и внешние оболочки называются валентными. Валентные электроны металла обладают особыми свойствами: они мобильны и могут легко перемещаться между атомами. Именно благодаря этим свойствам в случае металла образуются электронные облака, которые обеспечивают металлическую проводимость.
Таким образом, структура атома металла отличается от структуры атома неметалла своей электронной конфигурацией и наличием характеристических валентных электронов, дающих металлам специфические свойства.
Определение атома неметалла
Атом неметалла является основным строительным блоком для формирования химических соединений неметаллов. Он представляет собой наименьшую частицу неметаллического элемента, которая сохраняет его химические свойства.
Атомы неметаллов включают такие элементы, как кислород, азот, сера, хлор и фтор. Характерной особенностью атомов неметаллов является выраженная электроотрицательность, что позволяет им образовывать ковалентные связи с другими атомами.
Структура атома неметалла включает в себя ядро, состоящее из протонов и нейтронов, а также электроны, расположенные на энергетических уровнях. Количество протонов определяет атомный номер элемента, а количество электронов соответствует числу протонов, обеспечивая электрическую нейтральность атома.
Атомы неметаллов обладают различными свойствами, которые определяют их реакционную способность и способность образовывать соединения. Например, атомы кислорода обладают высокой электроотрицательностью и образуют двойные и тройные связи с другими элементами, что позволяет им образовывать разнообразные соединения, такие как оксиды и кислородсодержащие органические соединения.
Определение атома неметалла является важным понятием в химии, поскольку позволяет понять основные свойства и поведение неметаллических элементов и использовать их в различных химических реакциях и процессах.
Структура атома неметалла
Атом неметалла состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, которые образуют большую часть его массы. Протоны имеют положительный электрический заряд, а нейтроны являются нейтральными по заряду. Электронная оболочка состоит из электронов, которые обращаются по орбитам вокруг ядра.
Неметаллы имеют отличную структуру атома от металлов. В атомах неметаллов количество электронов в оболочках намного больше, чем количество протонов в ядре, что приводит к отрицательному заряду атома. Это делает атомы неметаллов склонными к принятию или обмену электронов в химических реакциях, чтобы достигнуть электронной стабильности.
Каждый неметалл характеризуется определенным количеством электронов на своей внешней электронной оболочке. В результате этого они могут образовывать ковалентные связи, общаясь с другими атомами неметаллов и образуя молекулы. Вместе с этим, атомы неметаллов также могут образовывать ионы, если они принимают или отдают электроны.
Таким образом, структура атома неметалла включает в себя ядро, состоящее из протонов и нейтронов, а также электронную оболочку, на которой находятся электроны. Количество электронов в внешней оболочке определяет химические свойства неметалла и его способность к образованию различных химических соединений.
Физические свойства атомов металлов

1. Кристаллическая структура: Атомы металлов обладают кристаллической структурой, что означает, что их атомы упорядочены в регулярные решетки. Это влияет на многие химические и физические свойства металлов, так как они могут легко сдвигаться и принимать различные формы.
2. Металлический блеск: Атомы металлов имеют способность отражать свет, что делает их блестящими и мерцающими. Это происходит из-за наличия свободных электронов, которые могут поглощать и переизлучать электромагнитное излучение в более высоких энергетических состояниях.
3. Проводимость электричества: Атомы металлов обладают хорошей проводимостью электричества, так как у них есть свободные электроны, которые легко могут перемещаться в структуре металла. Это объясняет их использование в проводниках и электрических цепях.
4. Проводимость тепла: Атомы металлов также обладают хорошей проводимостью тепла. Это связано с наличием свободных электронов, которые могут передавать энергию от одного атома к другому. Это делает металлы хорошими материалами для теплопроводных систем и конструкций.
5. Низкая электроотрицательность: Металлы имеют низкую электроотрицательность, что означает, что они имеют меньшую способность притягивать электроны. Это делает их более склонными к ионизации и образованию положительно заряженных ионов при реакциях.
6. Высокая плотность: Металлы обычно обладают высокой плотностью. Это связано с их компактной кристаллической структурой и сильными межатомными связями. Именно из-за этой высокой плотности металлы оказываются тяжелыми и прочными материалами.
7. Высокая температура плавления и кипения: Атомы металлов имеют высокую температуру плавления и кипения из-за сильных межатомных связей и энергии, необходимой для разрыва этих связей. Это делает металлы полезными в высокотемпературных приложениях, таких как промышленные печи и котлы.
Проводимость электричества у атомов металлов
Атомы металлов обладают особыми свойствами, позволяющими им проводить электричество. Эта способность связана с такими факторами, как наличие свободных электронов и специфическая структура ионной решетки.
Свободные электроны - ключевой фактор, обеспечивающий проводимость электричества. В атомах металлов на внешней энергетической оболочке находятся всего несколько электронов, которые слабо привязаны к ядру. Именно они могут свободно перемещаться по металлической решетке.
Каждый атом металла предоставляет свободным электронам свободное пространство для движения в особой структуре, называемой электронным облаком. Эти электроны, под действием внешнего электрического поля, начинают двигаться в определенном направлении, способствуя тем самым проводимости электричества.
Помимо свободных электронов, структура ионной решетки металлов также обладает важными свойствами, способствующими проводимости. Атомы металлов формируют кристаллическую решетку, где положительно заряженные ионы образуют шары или полушары, а свободные электроны заполняют пространство внутри этой структуры.
Таким образом, наличие свободных электронов и особая структура ионной решетки позволяют атомам металлов легко передавать электрический заряд. Это является основной причиной высокой проводимости электричества у металлов и их способности быть хорошими проводниками.
Вопрос-ответ

Какие атомы считаются металлами?
Считается, что атомы, обладающие свойствами металлов, являются металлами. Основными характеристиками металлов являются положительный заряд ядра, образование катионов, хорошая теплопроводность и электропроводность, блеск и деформируемость.
А какие атомы считаются неметаллами?
Атомы, которые не обладают свойствами металлов, считаются неметаллами. Они имеют отрицательный заряд ядра, могут образовывать анионы, плохо проводят тепло и электричество, а также обладают непроводящим блеском.
В чем основные отличия между атомами металлов и неметаллов?
Основные отличия между атомами металлов и неметаллов заключаются в их свойствах. Атомы металлов имеют положительный заряд ядра, образуют катионы, обладают хорошей теплопроводностью и электропроводностью, блеском и деформируемостью. В то же время, атомы неметаллов имеют отрицательный заряд ядра, могут образовывать анионы, плохо проводят тепло и электричество, и у них отсутствует блеск.
