Оксиды металлов являются одним из основных классов неорганических соединений. Они играют важную роль во многих химических реакциях и имеют различные физические и химические свойства. Для понимания и описания этих свойств необходимо определить степень окисления металла в оксиде.
Степень окисления металла в оксиде отражает, сколько электронов металл отдал или принял при образовании соединения. Это позволяет определить, как металл проявляет свои химические свойства. Определение степени окисления металла может быть полезно для предсказания его активности во взаимодействии с другими веществами.
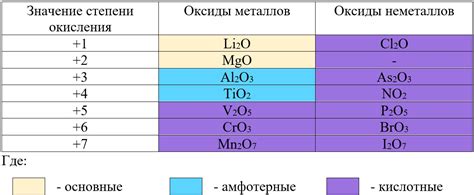
Для определения степени окисления металла в оксиде можно использовать несколько методов. Один из самых простых и распространенных методов - это использование правила электронейтральности, которое гласит, что общая сумма степеней окисления всех атомов в соединении должна быть равной нулю. Например, в оксиде алюминия (Al2O3) алюминий имеет степень окисления +3, так как требуется три электрона, чтобы превратить два атома алюминия в общую степень окисления 6+, а кислород имеет степень окисления -2.
Кроме того, степень окисления металла в оксиде можно определить, исходя из его положения в периодической системе элементов. В общем случае, металлы группы 1 имеют степень окисления +1, металлы группы 2 - +2, металлы группы 3 - +3, а металлы группы 4 и выше могут иметь различные степени окисления, в зависимости от конкретного соединения.
Окисление и оксиды

Окисление - это процесс, при котором атом или ион теряет электроны и повышает свою степень окисления. Окисление может происходить в химической реакции, в результате которой образуется оксид. Окисляющим агентом в реакции является вещество, которое принимает электроны от окисляемого вещества.
Оксиды металлов - это соединения металлов с кислородом. Они образуются в результате окисления металлов, их способность к окислению зависит от степени окисления, которая указывает, сколько электронов металл отдал или принял в окислительно-восстановительных реакциях.
Степень окисления у оксидов металлов может быть различной и определяется по правилам, которые учитывают заряд металла и кислорода в оксиде. Например, в оксидах некоторых металлов, таких как натрий (Na) и калий (K), степень окисления кислорода составляет -2. Таким образом, в оксиде натрия (Na2O) и оксиде калия (K2O) степень окисления натрия и калия составляет +1.
Оксиды металлов могут быть использованы в различных областях. Например, оксид цинка (ZnO) используется в косметике и солнцезащитных средствах, оксид железа (Fe2O3) применяется в производстве красок и пигментов, оксид алюминия (Al2O3) является основной составной частью алюминиевых сплавов.
Что такое окисление?

Окисление - это процесс, при котором вещество теряет электроны или повышает свою степень окисления. Это химическая реакция, которая может происходить как с участием кислорода, так и без него.
В химии окисление имеет два основных значения. Во-первых, это может быть реакция, при которой вещество соединяется с кислородом. В этом случае говорят о "добавлении кислорода". Например, железо может окисляться, образуя оксид железа Fe2O3.
Во-вторых, окислением называют процесс потери электронов веществом. Это обязательное правило при определении степени окисления в химических соединениях. Например, в воде (H2O) водород имеет степень окисления +1, а кислород -2.
Важно отметить, что процесс окисления является обратным процессу восстановления. Восстановление - это процесс, при котором вещество получает электроны или понижает свою степень окисления. Окисление и восстановление являются противоположными процессами, которые вместе образуют редокс-реакцию.
Какие существуют оксиды?
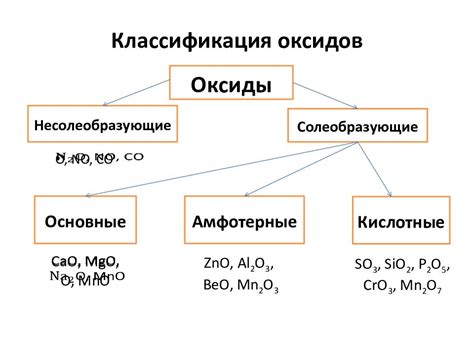
Оксиды - это класс химических соединений, которые образуются в результате реакции между металлами и кислородом. Они представляют собой соединения металла с кислородом, где металл выступает в роли катиона, а кислород - в роли аниона.
Оксиды металлов могут быть разных типов, в зависимости от степени окисления металла. Степень окисления определяется количеством электронов, которые металл отдал или принял при образовании соединения. Именно степень окисления металла делает оксиды металлов такими разнообразными и интересными.
Одним из важных типов оксидов металлов являются бинарные оксиды, которые состоят только из одного металла и кислорода. Примером является оксид железа Fe2O3 или ржавчина, которая имеет степень окисления +3 для железа.
Другим типом оксидов металлов являются соединения, в которых металл имеет различные степени окисления. Например, в оксиде меди(II) CuO степень окисления меди составляет +2, а в оксиде меди(I) Cu2O - +1. Такие соединения называются многоатомными оксидами.
Также существуют оксиды, в которых степень окисления металла не является простым числом. Например, в оксиде хрома(III) Cr2O3 степень окисления хрома составляет +3, а в оксиде хрома(VI) CrO3 - +6. Такие оксиды называют сложноатомными.
Какие методы определения степени окисления у оксидов металлов существуют?
Определение степени окисления у оксидов металлов является важной задачей в химии. Существует несколько методов, которые позволяют определить данную характеристику:
- Метод измерения массы. Один из самых простых и доступных методов определения степени окисления металла в оксиде. Суть метода заключается в измерении массы исходного оксида металла и массы выделившегося при реакции кислорода. По соотношению масс можно определить степень окисления металла.
- Метод с помощью реакций обмена. Данный метод основан на учете реакций обмена, которые происходят между оксидом металла и другими веществами. Путем анализа протекающих реакций и законов сохранения массы и заряда можно определить степень окисления металла в оксиде.
- Метод электрохимических измерений. Данный метод основан на использовании электрохимических явлений и процессов. Определение степени окисления металла происходит путем измерения потенциала окислительно-восстановительной реакции с участием оксида металла.
- Метод спектроскопии. С помощью спектроскопических методов, таких как инфракрасная, УФ-видимая и рентгеновская спектроскопия, можно определить электронную структуру оксида металла и тем самым выявить степень окисления металла.
Каждый из этих методов имеет свои преимущества и ограничения, поэтому выбор метода определения степени окисления металла зависит от конкретной задачи и условий проведения исследования.
Спектроскопический метод определения степени окисления у оксидов металлов
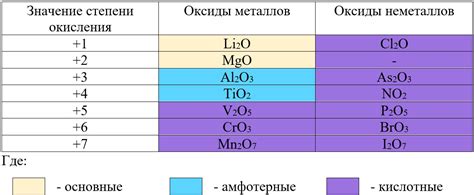
Спектроскопический метод является одним из наиболее надежных способов определения степени окисления у оксидов металлов. Этот метод основан на изучении электронного строения атомов и молекул, используя различные виды спектров.
Определение степени окисления у оксидов металлов с помощью спектроскопии происходит путем анализа изменения энергетических уровней электронов. Когда металл окисляется, происходит перераспределение электронов между энергетическими уровнями, что приводит к изменению спектральных характеристик.
Для проведения спектроскопического анализа используются различные методы, такие как ультрафиолетовая и видимая спектроскопия, инфракрасная спектроскопия, масс-спектрометрия и многие другие. Каждый из этих методов имеет свои особенности и позволяет получить информацию о различных аспектах электронной структуры оксидов металлов.
Спектроскопический метод определения степени окисления у оксидов металлов является важным инструментом в химическом анализе и научных исследованиях. Он позволяет получить детальную информацию о электронной структуре оксидов металлов, что помогает установить их химические свойства и потенциальные применения.
Таким образом, спектроскопический метод играет значительную роль в определении степени окисления у оксидов металлов, обеспечивая более точные и надежные результаты, чем другие способы анализа. Этот метод широко применяется в области химической и материаловедческой науки и имеет большой потенциал для дальнейшего развития и улучшения.
Электрохимический метод определения степени окисления у оксидов металлов
Определение степени окисления у оксидов металлов является важным шагом в изучении и исследовании химических соединений. Один из эффективных методов для определения степени окисления в оксидах металлов – это электрохимический подход.
Электрохимический метод основан на использовании электродных потенциалов и электрических токов, которые возникают в процессе окислительно-восстановительных реакций. Для определения степени окисления у оксидов металлов, в процессе которых происходит окисление металла, используются различные электроды.
Одним из наиболее распространенных электродов, используемых для определения степени окисления у оксидов металлов, является стандартный водородный электрод. Этот электрод является стандартом для измерения электродных потенциалов и позволяет сравнивать потенциалы различных электродов.
Для определения степени окисления у оксидов металлов с использованием электрохимического метода, проводятся измерения электродного потенциала на различных электродах при заданном значении тока. Затем, сравнивая полученные значения с данными о стандартных электродных потенциалах, можно определить степень окисления металла в оксиде.
Таким образом, электрохимический метод является эффективным и надежным инструментом для определения степени окисления у оксидов металлов. Он позволяет получить качественные и количественные данные о химическом составе оксидов металлов и использовать эти данные в дальнейших исследованиях и приложениях.
Химический метод определения степени окисления у оксидов металлов

Определение степени окисления у оксидов металлов можно провести с помощью химического метода. Для этого необходимо провести ряд определенных химических реакций, которые помогут определить количество оксигенов в соединении и, соответственно, степень окисления металла.
Один из самых распространенных методов определения степени окисления - метод перманганатной окислительной титровки. В ходе этого метода перманганатный ион, являющийся сильным окислителем, взаимодействует с окислительной способностью металла в оксиде. По результатам реакции можно определить количество окислителя, а соответственно, и степень окисления металла.
Другой метод - метод редокс-реакций. Он основан на изменении степени окисления металла в оксиде в ходе реакции с другими веществами. В ходе этого метода происходит взаимодействие металла с соединением, изменение его степени окисления и образование нового соединения. По характеру редокс-реакции можно определить степень окисления металла.
Также можно использовать методы комплексометрии и редокс-титровки. Метод комплексометрии основан на взаимодействии металла с комплексоном, который образует с ним стабильное соединение. При этом происходит изменение степени окисления металла, которую можно определить по результатам химической реакции.
Метод редокс-титровки также основан на изменении степени окисления металла в оксиде с помощью окислителя или восстановителя. По результатам титровки определяется количество окислителя или восстановителя, а, следовательно, и степень окисления металла.
Сравнение методов определения степени окисления у оксидов металлов
Определение степени окисления у оксидов металлов является важной задачей в химическом анализе. Существует несколько методов, которые позволяют определить степень окисления металла в оксиде.
Один из распространенных методов - это анализ по содержанию кислорода в соединении. Метод заключается в определении количества кислорода, связанного с металлом в оксиде. Этот метод основан на химической реакции окисления металла и последующем его дальнейшем разложении. Определение содержания кислорода может быть осуществлено с помощью различных методов, например, с помощью восстановления и дифференциальной термической анализа.
Еще один метод - это определение степени окисления через химическую реакцию окисления металла. В этом методе металл окисляется до соответствующего ионного состояния, например, путем взаимодействия с кислородом или другими окислителями. Изменение степени окисления металла может быть определено с помощью титрования или спектрофотометрии.
Также существует метод определения степени окисления на основе изучения характеристик связи между металлом и кислородом в соединении. Например, с помощью методов рентгеноструктурного анализа можно определить расстояние между атомами металла и кислорода, что позволяет сделать выводы о степени окисления металла.
Каждый из этих методов имеет свои преимущества и ограничения. Выбор метода зависит от требуемой точности, доступных технических средств и времени, которое может быть затрачено на проведение анализа. Поэтому важно выбрать наиболее подходящий метод в конкретной ситуации.
Вопрос-ответ

Какие еще способы есть для определения степени окисления металла в оксиде?
Помимо основных правил, существуют и другие способы определения степени окисления металла в оксиде. Например, можно использовать электрохимический и спектроскопический методы. Электрохимический метод основан на измерении электропотенциала раствора, содержащего металл и его соединения, а спектроскопический метод позволяет анализировать поглощение и испускание света соединениями металла, исходя из чего можно определить их степень окисления.
Какие факторы могут влиять на степень окисления металла в оксиде?
Степень окисления металла в оксиде может зависеть от нескольких факторов. Во-первых, это электроотрицательность атомов, входящих в соединение. Чем больше разница электроотрицательностей между металлом и кислородом, тем выше степень окисления металла. Во-вторых, режим окисления, в котором находится металл, может также влиять на его степень окисления в оксиде.
Каковы основные свойства оксидов металлов?
Оксиды металлов обладают рядом характерных свойств. Во-первых, они образуются в результате реакции металла с кислородом. Во-вторых, они могут быть кислыми, основными или амфотерными, в зависимости от своих реакций с кислотами и основаниями. В-третьих, они часто обладают высокой температурой плавления и кипения, а также хорошей проводимостью электричества и тепла. Кроме того, оксиды металлов могут образовывать соли при реакции с кислотами.
