Степень окисления металла – это число, которое показывает, сколько электронов металл отдал или принял при образовании ионов. Для определения степени окисления металла можно использовать таблицу Менделеева – один из основных инструментов химика.
В таблице Менделеева каждый элемент обозначается символом и приводится картина его атома, а также информация о его химических и физических свойствах. Важно отметить, что для большинства элементов в таблице указываются несколько возможных степеней окисления.
Определение степени окисления ведется на основе знания о следующих правилах и соглашениях, которые приняты в химии. Например, мы знаем, что степень окисления вещества равна нулю, если оно не является ионом. Также степень окисления атомов металлов в неорганических соединениях чаще всего положительна, так как они отдают электроны в реакции с другими элементами.
При определении степени окисления металла нужно учитывать его положение в таблице Менделеева и химический контекст – соединение, в котором он находится.
В ситуациях, где степень окисления металла не указана явно, можно использовать правила расчета. Например, если в соединении элемент образует ионы с отрицательным зарядом, то его степень окисления будет равна модулю этого заряда. Если металл образует соединение с другим металлом, то часто степень окисления определяется по разности электроотрицательностей металлов.
Структура таблицы Менделеева

Таблица Менделеева является основным инструментом в химии для организации и систематизации элементов. Она представляет собой удобную форму представления информации о химических элементах, их свойствах и химических реакциях.
Таблица Менделеева состоит из строк и столбцов. Каждый столбец представляет собой группу элементов с аналогичными свойствами, а каждая строка - период, который обозначает количество заполненных электронных оболочек у элементов в этой группе.
В таблице Менделеева элементы располагаются по возрастанию их атомных номеров. Атомный номер представляет собой количество протонов в ядре атома и определяет положение элемента в таблице. На пересечении строки и столбца находится символ химического элемента и его атомный номер.
Каждый элемент в таблице Менделеева имеет также указанные значения степени окисления. Степень окисления - это числовое значение, которое показывает, сколько электронов перешло от атома элемента к атому другого элемента. Степень окисления имеет важное значение при определении состава и свойств химических реакций.
Таблица Менделеева является не только инструментом для определения степени окисления металла, она также содержит информацию о других химических свойствах элементов, таких как атомная масса, электроотрицательность и возможные ионы, которые элемент может образовывать.
Нумерация степеней окисления
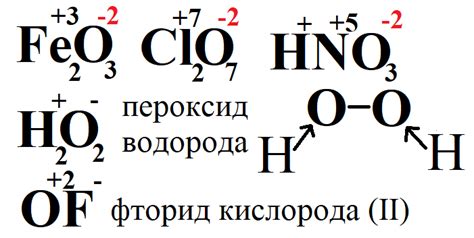
Степень окисления металла - это числовое значение, которое показывает, сколько электронов металл отдал или принял при образовании соединения. Чтобы определить степень окисления металла, можно использовать таблицу Менделеева, которая содержит информацию о химических элементах и их соединениях.
В таблице Менделеева можно найти информацию о том, какие степени окисления могут принимать различные металлы. Обычно степень окисления металла указывается римскими цифрами и может иметь положительное или отрицательное значение.
Нумерация степеней окисления металлов основана на правиле электронной перестройки. К примеру, некоторые металлы, такие как железо (Fe), могут принимать несколько различных степеней окисления. Наиболее распространенными степенями окисления железа являются +2 и +3, однако также возможны и другие степени окисления, например, +1 или +4. Аналогично, металлы могут принимать различные степени окисления в зависимости от условий реакции и соединения, в котором они находятся.
Нумерация степеней окисления металлов является важным инструментом для химиков, поскольку позволяет более точно определить состав и свойства соединений. Знание степеней окисления металлов также помогает в проведении химических реакций и вычислении стехиометрических коэффициентов.
Определение степени окисления по номеру группы

Степень окисления (валентность) – это числовое значение, которое показывает, сколько электронов металл отдал или принял при образовании ионов. Определение степени окисления металла по его номеру группы в таблице Менделеева является одним из способов определения валентности.
В таблице Менделеева металлы разделены на группы, в каждой из которых находятся элементы с схожим количеством внешних электронов. Номер группы указывает на число электронов, которое металл может отдать или принять при реакции с другими веществами.
Например, элементы первой группы (щелочные металлы) имеют один внешний электрон и, соответственно, степень окисления +1. Вторая группа (щелочноземельные металлы) имеет два внешних электрона, а их степень окисления равна +2.
Однако не всегда степень окисления металла соответствует его номеру группы. Некоторые элементы имеют различные степени окисления в зависимости от условий реакции. В таких случаях следует опираться на информацию о конкретной реакции или использовать другие методы для определения валентности металла.
Определение степени окисления по номеру периода

Определение степени окисления металла по таблице Менделеева позволяет установить его электрохимическую активность и способность образовывать ионы с определенным зарядом. Важным фактором, определяющим степень окисления металла, является его положение в периодической системе элементов.
Номер периода, в котором расположен металл, указывает на количество электронных оболочек, занимающих место между ядром атома и его внешними электронами. Каждый период соответствует определенному уровню заполнения электронных оболочек.
Сопоставляя номер периода с таблицей степеней окисления металлов, можно определить предполагаемые варианты ионов данного металла. Например, для металла, находящегося во втором периоде, возможны степени окисления +2 и +4, так как у металлов этого периода две электронные оболочки.
Однако следует помнить, что реальная степень окисления металла может быть определена также с учетом других факторов, таких как валентность, электроотрицательность других элементов в соединении и условия окислительно-восстановительных реакций.
Таблица степеней окисления металлов по номеру периода является важным инструментом для определения возможных вариантов ионов в соединениях с металлами и позволяет предсказывать и объяснять их химические свойства.
Исключения из общих правил
Определение степени окисления металлов может быть довольно простым, если учесть общие правила и законы химии. Однако существуют исключения из этих общих правил, которые требуют более тщательного анализа и внимания.
Первым исключением является металл группы 1 – литий (Li), натрий (Na), калий (K) и другие. Обычно степень окисления этих металлов составляет +1. Однако, в некоторых случаях они могут иметь степень окисления +2, как в соединении металла с молекулой кислорода.
Вторым исключением являются металлы группы 2 – бериллий (Be), магний (Mg), кальций (Ca) и другие. Обычно степень окисления этих металлов составляет +2. Однако, в ряде исключительных случаев, они могут образовывать соединения с металлами группы 17 (галогены), где степень окисления может составлять +1.
Также степень окисления металлов может зависеть от специфических условий реакции. В некоторых случаях, степень окисления металла может изменяться в зависимости от среды реакции, ее pH-значения и наличия других реагентов.
Все эти исключения подчеркивают важность тщательного анализа и обращения к таблице Менделеева для определения степени окисления металла. Ученые всегда стремятся понять все мелочи и особенности химических реакций и свойств элементов, чтобы достичь более точных и полных результатов исследований.
Практический пример: определение степени окисления металла

Определение степени окисления металла по таблице Менделеева — важный процесс в химических исследованиях. Рассмотрим практический пример на примере определения степени окисления железа в соединении FeCl3.
Сначала необходимо определить остальные ионы в соединении. Для FeCl3 это хлоридные ионы Cl-. Зная, что железо имеет положительную степень окисления, воспользуемся таблицей Менделеева для определения возможных значений.
| Металл | Степень окисления |
|---|---|
| Fe | +2, +3 |
Таким образом, степень окисления железа может быть либо +2, либо +3. Теперь необходимо определить соотношение между ионами железа и хлорида. Для этого рассмотрим заряды каждого иона:
- Хлоридный ион Cl- имеет заряд -1;
- Ион железа с положительной степенью окисления имеет заряд, которому нужно уравняться.
Так как ионы в соединении должны быть электрически нейтральными, необходимо учесть различные соотношения ионов железа и хлорида, чтобы получить нейтральное соединение. В данном случае, для образования FeCl3 требуется 3 иона хлора и 1 ион железа:
3Cl- + Fe3+ → FeCl3
Таким образом, степень окисления железа в соединении FeCl3 равна +3.
Влияние степени окисления на физические и химические свойства

Степень окисления металла имеет значительное влияние на его физические и химические свойства. Физические свойства металла, такие как плотность, плавление и кристаллическая структура, могут изменяться в зависимости от степени окисления металла.
Окисление металла приводит к образованию окиси, которая может быть как ионной, так и ковалентной. Если металл образует ионную оксидную форму, то его физические свойства, такие как плотность и плавление, могут измениться. Например, чем выше степень окисления металла, тем выше его плотность и плавление. Это связано с увеличением числа электронов вокруг иона металла, что приводит к усилению электростатического притяжения между ионами.
С другой стороны, окисление металла может также приводить к изменению химических свойств. Высокая степень окисления металла может привести к образованию более активных ионов, способных к более интенсивным реакциям с другими веществами. Например, металл с более высокой степенью окисления будет более склонен к окислительно-восстановительным реакциям и может проявлять большую реакционную активность.
Степень окисления металла также может влиять на его растворимость в различных растворителях. Металлы с разными степенями окисления могут иметь разную аффинность к растворителю, что может отражаться в их растворимости. Например, металл с более высокой степенью окисления может быть более растворимым в кислотных растворах, в то время как металл с низкой степенью окисления может быть более растворимым в щелочных растворах.
В целом, степень окисления металла играет важную роль в определении его физических и химических свойств. Она может влиять на плотность, плавление, кристаллическую структуру, реакционную активность и растворимость металла. Понимание и учет степени окисления металла являются важными аспектами в изучении его свойств и применении в различных областях науки и промышленности.
Применение знания степени окисления в химических реакциях

Степень окисления металла играет важную роль в химических реакциях, так как она позволяет определить, сколько электронов металл отдает или принимает при образовании соединений. Это знание особенно полезно при балансировке химических уравнений и определении веществ, участвующих в реакции.
Металлы с положительной степенью окисления склонны отдавать электроны, образуя ионы положительного заряда. Например, алюминий имеет степень окисления +3, что означает, что он отдает три электрона при вступлении в реакцию. В свою очередь, металлы с отрицательной степенью окисления склонны принимать электроны и образовывать ионы отрицательного заряда. Например, кислород имеет степень окисления -2, что означает, что он принимает два электрона.
Знание степени окисления металла позволяет установить соотношение между металлом и неметаллом в химическом соединении. Например, в соединении NaCl (хлорид натрия) натрий имеет степень окисления +1 и отдает один электрон, а хлор имеет степень окисления -1 и принимает один электрон. Это соотношение может быть использовано при балансировке химического уравнения, чтобы установить количество ионов и электронов, участвующих в реакции.
Кроме того, знание степени окисления металла позволяет определить окислитель и восстановитель в химической реакции. Окислитель - вещество, способное принимать электроны и при этом само восстанавливаться, а восстановитель - вещество, способное отдавать электроны и при этом само окисляться. Зная степень окисления металла, можно определить, является ли он окислителем или восстановителем в реакции и указать его роль.
В заключение, знание степени окисления металла позволяет более глубоко понять и изучать химические реакции. Оно помогает определить, сколько электронов металл отдает или принимает при образовании соединений, установить соотношение между металлом и неметаллом, а также определить роль металла в реакции как окислителя или восстановителя. Это знание является основой для балансировки химических уравнений и более глубокого понимания химии в целом.
Вопрос-ответ

Как определить степень окисления металла по таблице Менделеева?
Для определения степени окисления металла по таблице Менделеева необходимо обратиться к электрохимическому потенциалу металла. В таблице Менделеева можно найти электрохимический ряд металлов, где металлы расположены в порядке возрастания их способности участвовать в окислительно-восстановительных реакциях. Степень окисления металла определяется по разнице в электрохимическом потенциале между этим металлом и стандартным электродом водорода.
Как использовать таблицу Менделеева для определения степени окисления металла?
Для определения степени окисления металла по таблице Менделеева следует сравнить электрохимический потенциал данного металла с электрохимическим потенциалом других металлов из таблицы. Металлы с более положительным электрохимическим потенциалом считаются более активными и имеют более высокую степень окисления, в то время как металлы с более отрицательным электрохимическим потенциалом считаются менее активными и имеют более низкую степень окисления.
