Взаимодействие металлов играет важную роль в различных сферах нашей жизни. От строительства до производства электроники - металлы используются повсюду. Однако, не все металлы подходят для совместного использования, так как они могут негативно влиять друг на друга. Поэтому важно знать, как определить возможность взаимодействия металлов, чтобы избежать нежелательных последствий.
Существуют различные способы определения возможности взаимодействия металлов. Один из них - анализ электрохимической активности металлов. Каждый металл имеет свой уровень активности, который определяет его способность взаимодействовать с другими металлами. Например, металл с более высоким уровнем активности может вызвать коррозию металла с более низким уровнем активности.
Помимо анализа электрохимической активности, можно также использовать таблицы электрической потенциальной серии для определения возможности взаимодействия металлов. В этих таблицах металлы упорядочены по их способности выступать как аноды или катоды в электрохимической реакции. Если металл находится выше в таблице, то он будет являться анодом, а если ниже - катодом. Эта информация позволяет определить возможность возникновения реакций окисления-восстановления между металлами.
Определение взаимодействия металлов: основные аспекты и признаки

Взаимодействие металлов – важный аспект химических процессов, который имеет большое значение в промышленности и научных исследованиях. Для определения возможности взаимодействия металлов необходимо учитывать несколько ключевых признаков.
1. Электрохимические ряды. Один из основных способов определения взаимодействия металлов – анализ их положения в электрохимическом ряду. Металлы, занимающие более низкое положение в ряду, могут реагировать с металлами, находящимися выше. Например, цинк может реагировать с медью, так как он находится ниже в электрохимическом ряду. Электрохимические ряды являются важным инструментом для предсказания химических реакций между металлами.
2. Коррозия. Коррозия – нежелательное взаимодействие металла с окружающей средой, которое может привести к его разрушению. Некоторые металлы, такие как железо, подвержены коррозии при взаимодействии с кислородом в воде или влажном воздухе. Однако, существуют металлы, такие как золото или платина, которые практически не подвержены коррозии. Использование анодной и катодной защиты является одним из способов минимизации взаимодействия металлов и предотвращения коррозии.
3. Растворимость. Растворимость металлов в различных растворителях также может свидетельствовать о их взаимодействии. Например, некоторые металлы, такие как натрий или калий, легко растворяются в воде, что свидетельствует о возможности их реакций с другими веществами. С другой стороны, некоторые металлы, такие как серебро или золото, практически не растворяются в воде и маловероятно вступят в реакцию с другими веществами.
Взаимодействие металлов играет значительную роль в многих отраслях, включая строительство, электронику, автомобильную промышленность и другие. Понимание основных аспектов и признаков взаимодействия металлов позволяет эффективно управлять и контролировать химические процессы, связанные с этими материалами.
Химический состав металлических элементов
Металлы - это группа химических элементов, обладающих определенными свойствами, такими как блеск, теплопроводность, электропроводность и деформируемость. Химический состав металлических элементов определяется их атомной структурой и количеством электронов во внешней электронной оболочке.
Металлы в таблице химических элементов располагаются слева и в центре, образуя левую часть периодической системы. Они включают такие элементы, как железо, алюминий, медь, свинец, никель и многие другие. Металлы, как правило, имеют положительные окислительные степени, так как они легко отдают свои внешние электроны.
Важным фактором в химическом составе металлов является наличие примесей. Примеси могут влиять на электрохимические свойства металла, его коррозионную стойкость и другие свойства. Например, добавление хрома к железу создает нержавеющую сталь, которая обладает высокой коррозионной стойкостью.
Существуют различные способы определения химического состава металлических элементов. Один из них - анализ спектральными методами, основанный на измерении эмиссии или поглощения электромагнитного излучения материалом. Также используются химические методы анализа, такие как растворение образца металла в кислоте и последующий анализ полученного раствора.
Изучение химического состава металлических элементов позволяет не только определить их свойства, но и разрабатывать новые материалы с определенными свойствами. На основе изучения химического состава и структуры металлов разрабатываются различные сплавы, металлокерамика и композитные материалы, которые находят применение в разных отраслях промышленности.
Физические свойства металлов
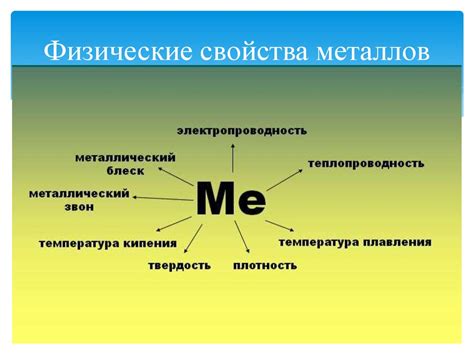
Проводимость электричества и тепла. Одним из характерных свойств металлов является их высокая проводимость электричества и тепла. Это обусловлено наличием свободных электронов, которые легко передают электрический и тепловой ток по соединенным атомам.
Пластичность и деформируемость. Металлы обладают такими свойствами, как пластичность и деформируемость. Их кристаллическая решетка способствует перемещению слоев атомов, что позволяет металлам быть подверженными пластическим деформациям без разрушения.
Своеобразные физические свойства. Металлы обладают некоторыми уникальными физическими свойствами. Например, искристость, которая проявляется при сложении двух металлов их порошка. Расцветка металлов также может варьироваться, от ярко-серебристой до золотисто-красной, в зависимости от структуры и свойств атомов.
Термоэлектрические свойства. Многие металлы обладают термоэлектрическими свойствами, то есть способностью генерировать электрический ток при изменении температуры. Это свойство находит применение в различных устройствах и технологиях, включая термоэлектрические генераторы и охладители.
Плотность и твердость. Металлы обладают высокой плотностью и твердостью, что делает их прочными материалами для различных конструкций. У некоторых металлов, таких как железо, есть способность к плавке и способность приобретать различные формы при нагревании и охлаждении.
Магнитные свойства. Некоторые металлы, такие как железо и никель, обладают магнитными свойствами. Это позволяет использовать их в производстве магнитов и электромагнитов, а также в различных приборах и устройствах, связанных с магнетизмом.
Электрохимическая активность металлов

Электрохимическая активность металлов – это способность металлов образовывать ионные соединения с веществами в процессе химических реакций. Она определяется степенью устойчивости металлов к окислительно-восстановительным реакциям.
Наиболее активные металлы, такие как щелочные и щелочноземельные металлы, имеют низкую энергию ионизации и высокую аффинность к электронам. Они легко окисляются и образуют положительные ионы, поэтому они активно вступают в реакции. Наоборот, металлы с низкой активностью, такие как платина и золото, имеют высокую энергию ионизации и низкую аффинность к электронам, что делает их менее активными в химических реакциях.
Электрохимическая активность металлов можно определить с помощью электрохимических реакций, таких как реакция окисления и редукции. При этом металл может выступать в роли одновременно окислителя и восстановителя. Например, металл медь может переходить из ионизированного состояния (Cu2+) в нейтральное состояние (Cu) и наоборот, в зависимости от условий реакции.
Электрохимическая активность металлов имеет практическое применение, так как она определяет их способность быть использованными в различных процессах, например, при производстве электрической энергии или при проведении гальванических покрытий. Знание о электрохимической активности металлов помогает выбирать оптимальные материалы для конкретных целей и избегать нежелательных химических реакций и коррозии.
Коррозия и окисление металлов

Коррозия и окисление металлов – это процессы, которые приводят к разрушению и изменению свойств металлических поверхностей под воздействием окружающей среды. Коррозия является одной из основных проблем, с которой сталкиваются металлурги и инженеры, так как она приводит к потере прочности и долговечности материалов.
Окисление металлов – это процесс реакции металла с кислородом воздуха или другими окислителями. При окислении металла на его поверхности образуется окисная пленка, которая может защищать металл от дальнейшего окисления или, наоборот, способствовать его коррозии.
Коррозия металлов, в свою очередь, является электрохимическим процессом, вызванным потенциалным различием между компонентами металла и окружающей средой. В результате коррозии на поверхности металла могут образовываться поры, трещины или другие дефекты, что приводит к уменьшению прочности и интегритета материала.
Один из методов защиты металлов от коррозии – это нанесение защитного покрытия, которое предотвращает контакт металла с окружающей средой. Для этого используются различные материалы, такие как краски, лаки, антикоррозийные покрытия и покрытия на основе оксида цинка или алюминия.
- Как правило, металлы с большим потенциалом окисления являются более подверженными к коррозии. Например, алюминий и цинк более активны, чем железо или сталь, и более быстро окисляются.
- Наличие влаги и солей является одной из основных причин коррозии металлов. Вода, особенно с минеральными солями, проводит электрический ток, который ускоряет коррозионные процессы.
Эффект гальванической пары взаимодействующих металлов

Гальваническая пара - это электрохимическая система, состоящая из двух разных металлов, которые взаимодействуют между собой в присутствии электролита. В такой системе происходит перенос электронов между металлами, что приводит к возникновению электрического потенциала между ними.
Взаимодействие металлов в гальванической паре обусловлено их различной активностью в ряду напряжений электродных потенциалов. Металлы в гальванической паре можно разделить на активный и пассивный. Активный металл обладает более высоким электродным потенциалом и является анодом, а пассивный – менее активным металлом, который будет действовать как катод.
При взаимодействии активного и пассивного металлов происходит реакция окисления-восстановления, в которой активный металл окисляется, а пассивный металл восстанавливается. Такое взаимодействие может привести к коррозии активного металла, так как при окислении он переходит в ионную форму и растворяется в электролите.
Определить возможность взаимодействия металлов можно с помощью таблицы электродных потенциалов. Металлы, расположенные ближе к верху таблицы, являются активными и будут окисляться. Металлы, расположенные ближе к нижней части таблицы, являются пассивными и будут восстанавливаться. Чем больше разница в электродных потенциалах металлов, тем более интенсивно будет происходить процесс окисления.
Методы определения взаимодействия металлов

1. Химические реакции
Один из самых распространенных методов определения взаимодействия металлов - это изучение их химических реакций. Металлы могут проявлять различные взаимодействия при контакте с другими веществами. Например, реакция окисления металла может привести к образованию окиси металла или соли. С помощью химических реакций можно определить, какие металлы способны взаимодействовать друг с другом и какие реакции при этом происходят.
2. Электрохимические методы
Для определения возможности взаимодействия металлов часто используют электрохимические методы. Один из таких методов - измерение электродного потенциала металлов. Каждый металл имеет свой уникальный электродный потенциал, который может меняться при взаимодействии с другими металлами. Поэтому с помощью электрохимических методов можно определить, какие металлы могут вступать в реакцию и имеют электрический потенциал, позволяющий им взаимодействовать друг с другом.
3. Использование электролитической серии
Для определения возможности взаимодействия металлов можно использовать электролитическую серию, которая упорядочивает металлы по степени их активности. Электролитическая серия представляет собой список металлов, упорядоченных в порядке убывания их электродного потенциала. Металлы с более высоким потенциалом имеют большую активность и могут вытеснить из раствора ионы металлов с более низким потенциалом. С помощью электролитической серии можно определить, какие металлы могут вступать в реакцию и вытеснять другие металлы из растворов и солей.
4. Анализ внешних свойств металлов
Также взаимодействие металлов можно определить по анализу их внешних свойств. К примеру, металлы с высокой реактивностью могут образовывать коррозию при контакте с влагой или кислотами. Если при взаимодействии двух металлов один из них образует покрытие на поверхности другого металла или препятствует его коррозии, это может указывать на их взаимодействие. Также можно обратить внимание на изменение цвета, физические свойства или состав сплавов при их взаимодействии, что также может свидетельствовать о возможности их взаимодействия.
Вопрос-ответ

Как определить возможность взаимодействия металлов?
Возможность взаимодействия металлов можно определить, рассмотрев их электрохимический ряд. В этом ряду металлы упорядочены в порядке убывания их способности к окислению. Если металл находится выше другого в ряду, он сможет вытеснить его из его раствора и будет происходить реакция. Таким образом, металлы выше в ряду могут реагировать с металлами ниже.
Какова основная причина взаимодействия металлов?
Основной причиной взаимодействия металлов является разность потенциалов электродов, которая возникает из-за различных энергий ионизации элементов. Металлы с более высоким потенциалом электрода имеют большую способность окисляться, а металлы с более низким потенциалом электрода имеют большую способность восстанавливаться.
Какие факторы могут влиять на возможность взаимодействия металлов?
На возможность взаимодействия металлов могут влиять такие факторы, как концентрация реагирующих растворов, температура, наличие катализаторов и других веществ, а также условия проведения реакции. Например, концентрация раствора металла может влиять на скорость реакции и возможность образования осадка.
Какие металлы могут реагировать с водой?
Реакция металлов с водой зависит от их активности. Наиболее активные металлы, такие как щелочные и щелочноземельные металлы (например, натрий, калий, кальций, магний), реагируют с водой, выделяя водород. Более низкоактивные металлы, такие как железо или цинк, не реагируют с водой при обычных условиях, но могут реагировать с кислотами.
Можно ли предсказать реакцию между двумя металлами?
Реакцию между двумя металлами можно предсказать, рассмотрев их положение в электрохимическом ряду. Если один металл находится выше другого в ряду, то он способен вытеснить его из раствора и провести реакцию. Если оба металла находятся в ряду реактивности, то они не должны вступать в химическую реакцию друг с другом.
