Электрохимический эквивалент металла является важным параметром, который позволяет определить массу вещества, которое проходит через электролитическую ячейку за определенное время. Этот параметр имеет большое значение при проведении экспериментов и расчетов в области электрохимии. Но как его определить с достоверностью? Существует несколько различных методов, которые позволяют получить точные результаты.
Одним из методов определения электрохимического эквивалента металла является метод электролиза. При этом методе металл изолируют в виде электрода в растворе своей соли. Затем на электрод подают постоянный электрический ток определенной силы. По прошествии времени определяют массу осажденного на электроде металла, которая позволяет рассчитать его электрохимический эквивалент.
Также можно использовать метод Кубица-Крово.
Измерение массы осадка проводят с помощью аналитических весов, которые позволяют получить достоверные и точные результаты. При этом необходимо учитывать такие факторы, как погрешность весов и влияние окружающей среды. Важно также учесть факторы, которые могут влиять на процесс осаждения металла, например, состав электролита, температура и сила тока.
Использование точных методов определения электрохимического эквивалента металла позволяет получить надежные результаты, которые будут использованы в дальнейших расчетах и исследованиях в области электрохимии. Это особенно важно при изучении различных физико-химических процессов и при проектировании новых электрохимических систем и устройств.
Раздел 2. Использование гальванических ячеек для расчета электрохимического эквивалента

Гальваническая ячейка — это электрохимическая система, в которой происходит превращение химической энергии в электрическую с помощью спонтанной реакции окисления-восстановления. Такие ячейки активно используются для определения электрохимического эквивалента металла.
Для проведения расчета электрохимического эквивалента металла в гальванической ячейке необходимо знать электродные потенциалы реагирующих полуэлементов и их концентрации. Сначала определяется потенциал исследуемого металла относительно стандартного электрода воздуха, а затем происходит измерение силы тока, которая протекает через ячейку.
С помощью показаний силы тока и электродных потенциалов реагирующих частей гальванической ячейки можно определить электрохимический эквивалент металла. Значение эквивалента вычисляется по формуле, которая учитывает мольное количество вещества, переданное в процессе реакции окисления-восстановления, и количество электричества, пропорциональное силе тока.
Использование гальванических ячеек для расчета электрохимического эквивалента металла позволяет получить достоверные результаты и использовать их для последующих расчетов и применений в различных областях науки и техники.
Раздел 3. Метод вольтамперометрии в определении электрохимического эквивалента металла

Вольтамперометрия является одним из основных методов определения электрохимического эквивалента металла. Этот метод основан на измерении зависимости электрического тока от напряжения при проведении электрохимического процесса на электроде.
Для проведения вольтамперометрических измерений используются специальные приборы - вольтамперометры. Они позволяют с высокой точностью измерить ток и напряжение, а также построить вольтамперометрическую кривую, которая отображает зависимость тока от напряжения.
Полученные вольтамперометрические кривые позволяют определить электрохимический эквивалент металла путем расчета площади петли на кривой. Эта площадь пропорциональна количеству переходящих веществ на электроде и, следовательно, связана с электрохимическим эквивалентом металла.
Определение электрохимического эквивалента металла с помощью метода вольтамперометрии позволяет получить достоверные результаты, так как этот метод является одним из самых точных и надежных. Он широко применяется в химической и электрохимической промышленности для контроля качества и исследования свойств различных металлических материалов.
Раздел 4. Зависимость электрохимического эквивалента металла от концентрации электролита
Зависимость электрохимического эквивалента металла от концентрации электролита является важным аспектом при определении данной величины. Концентрация электролита влияет на скорость электрохимической реакции и количественное образование продуктов этой реакции. Изменение концентрации электролита может привести к изменению электрохимического эквивалента металла и, следовательно, к изменению результатов расчетов.
При увеличении концентрации электролита происходит увеличение количества ионов в растворе, что способствует ускорению электрохимической реакции. Это может привести к повышению скорости образования продуктов и увеличению электрохимического эквивалента металла. Важно учитывать эту зависимость при проведении экспериментов и расчетах.
Однако, существует определенный предел концентрации электролита, после которого изменение концентрации не оказывает значительного влияния на электрохимический эквивалент металла. Это связано с тем, что при достижении определенной концентрации электролита реакция насыщается и дальнейшее увеличение концентрации не приводит к увеличению скорости реакции.
Для определения зависимости электрохимического эквивалента металла от концентрации электролита можно использовать экспериментальный метод, проводя серию измерений при разных значениях концентрации. Полученные данные могут быть представлены в виде графика, на основе которого можно определить тренд изменения электрохимического эквивалента в зависимости от концентрации электролита.
Таким образом, понимание взаимосвязи между электрохимическим эквивалентом металла и концентрацией электролита является важным для достоверных расчетов. Учет этой зависимости позволяет проводить точные и надежные определения электрохимического эквивалента металла при различных условиях эксперимента.
Раздел 5. Методом амперометрии определяем электрохимический эквивалент металла
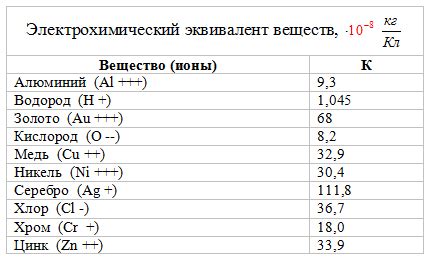
Метод амперометрии является одним из основных методов определения электрохимического эквивалента металла. Он основан на измерении количества электричества, которое проходит через электрод при электролизе раствора соли металла.
Для проведения амперометрического определения электрохимического эквивалента необходимо подключить к электроду источник тока, который создаст электрическую силу протекания процесса. Также потребуются амперметр и хронометр для измерения продолжительности электролиза.
Процесс определения электрохимического эквивалента методом амперометрии состоит из нескольких этапов. Сначала необходимо подготовить раствор соли металла с известной концентрацией. Затем в этот раствор погружаются два электрода: рабочий электрод и контрэлектрод. Рабочий электрод выполнен из исследуемого металла, а контрэлектрод – из инертного материала.
После подготовки электродов проводится электролиз рабочего раствора. При этом через амперметр проходит ток, который может быть измерен величиной. После измерения тока и продолжительности электролиза можно рассчитать количество электричества, прошедшего через систему. Зная массу использованного рабочего электрода, можно определить электрохимический эквивалент металла.
Раздел 6. Определение электрохимического эквивалента металла с помощью растворимых соединений

В методике определения электрохимического эквивалента металла с помощью растворимых соединений применяется принцип реакции между металлом и соответствующим растворимым соединением, при которой происходит обмен электронов.
Для проведения таких опытов необходимо подготовить исследуемое вещество, обеспечивающее высвобождение металла из его соединения, и подходящий электролитический электрод. В качестве электролитического электрода чаще всего используется платиновый электрод, который служит для получения окислителя на границе раздела с растворимым соединением.
При помощи определенного количества исследуемого соединения и платинового электрода проводится контролируемая электролитическая реакция, при которой осуществляется процесс окисления металла и выделения нужного простого вещества. Затем с помощью кулонометра измеряется количество электричества, прошедшего через систему во время реакции.
Наконец, зная количество прошедшего электричества и молярную массу исследуемого соединения, можно рассчитать электрохимический эквивалент металла. Этот метод позволяет проводить точные расчеты без необходимости использования сложной аппаратуры и аналитических методов.
Раздел 7. Комплексоны в определении электрохимического эквивалента металла

Комплексоны — это соединения, образующиеся при взаимодействии металлов с органическими соединениями, в результате которого образуются стабильные комплексы. В определении электрохимического эквивалента металла, комплексоны могут играть важную роль как способ улучшения конкретных характеристик метода.
Применение комплексообразующих веществ позволяет уменьшить число шагов в определении электрохимического эквивалента металла, что приводит к повышению точности и скорости анализа. Кроме того, комплексоны способны существенно усилить чувствительность метода, что особенно важно при работе со слабоэквивалентными веществами.
Например, в редокс-титровании комплексообразование может использоваться для улучшения чувствительности по отношению к ионам металла. Для этого в титранте добавляют комплексообразующий реагент, который образует стабильный комплекс с металлическим ионом. Такой комплекс обладает другими физико-химическими свойствами и может быть более устойчивым в растворе, что позволяет определить электрохимический эквивалент металла с большей точностью.
Также комплексоны могут использоваться для селективного определения электрохимического эквивалента металла в присутствии других ионов. Например, комплексообразующий реагент может образовывать стабильный комплекс только с определенным металлическим ионом, что позволяет идентифицировать и определить только этот ион в смеси. Это особенно полезно при определении следовых концентраций металлов в различных образцах.
Раздел 8. Современные методы определения электрохимического эквивалента металла

Современные методы определения электрохимического эквивалента металла представляют собой комплексные и высокоточные процедуры, основанные на использовании современной аппаратуры и аналитических методов. Они позволяют получить достоверные и точные результаты, необходимые для научных и инженерных исследований, а также для производственных целей.
Один из таких методов - метод электрохимической коррозии, основанный на измерении тока, протекающего через электролитическую ячейку с металлическими электродами. Этот метод позволяет определить электрохимический эквивалент металла путем измерения скорости коррозии и вычисления соответствующих параметров.
Другой метод - метод гравиметрии, основанный на взвешивании металлического образца до и после проведения электрохимической реакции. С помощью этого метода можно определить изменение массы образца и вычислить электрохимический эквивалент металла через соотношение массы и заряда.
Также существуют методы, основанные на использовании спектроскопических методов анализа, таких как методы оптической и электронной спектроскопии. Они позволяют определить электрохимический эквивалент металла путем измерения эмиссии или поглощения определенных спектральных линий или энергий.
Все эти современные методы обладают высокой точностью и позволяют получить достоверные результаты. Они позволяют определить электрохимический эквивалент металла с высокой степенью точности и надежности, что является важным для различных научных и инженерных исследований, а также для производства и контроля качества продукции.
Вопрос-ответ

Что такое электрохимический эквивалент металла?
Электрохимический эквивалент металла - это количество вещества, осаждаемого или растворяющегося в результате электрохимической реакции на электроде, когда через него протекает 1 кулон электричества.
Зачем нужно определять электрохимический эквивалент металла?
Определение электрохимического эквивалента металла позволяет установить связь между электрическим током и химической реакцией на электроде. Это важно для множества приложений, таких как электрохимические процессы в батареях, гальваническом покрытии и коррозии металлов.
Какие методы существуют для определения электрохимического эквивалента металла?
Существует несколько методов для определения электрохимического эквивалента металла. Одним из них является метод измерения массы осажденного вещества на электроде. Другой метод основан на измерении количества электричества, протекающего через электрод. Существуют также методы, использующие спектральные и физические характеристики вещества на электроде.
Как достоверно расчитать электрохимический эквивалент металла?
Для достоверного расчета электрохимического эквивалента металла необходимо провести эксперименты и измерения, следуя определенным методам. Ключевыми моментами являются точность измерений, учет возможных погрешностей и повторяемость экспериментов. Также важно провести анализ результатов и проверить их соответствие теоретическим предсказаниям.
