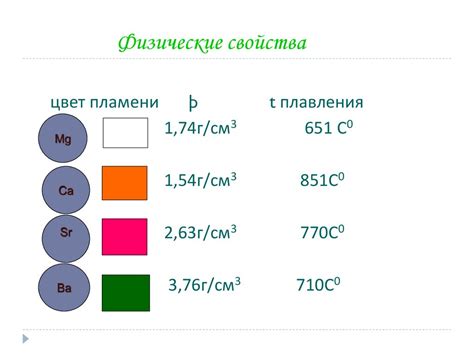
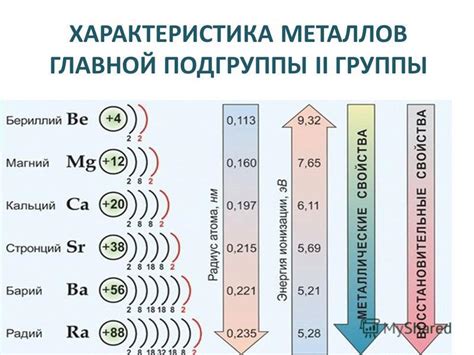
Металлы в нашей жизни окружают нас повсюду: они используются для создания различных изделий, строительных конструкций, и даже в медицине. Но не все металлы одинаково активны и подвержены окислению. Чтобы определить, что это за металл перед нами - активный или неактивный, можно использовать несколько простых методов.
Первый метод основан на наблюдении за реакцией металла с окружающей средой. Активные металлы обычно быстро реагируют с кислородом, влагой или кислотами, что приводит к их окислению и образованию оксидов. Неактивные металлы, напротив, обычно проявляют большую устойчивость к окислению и не реагируют с окружающей средой. Наблюдение за этими реакциями может помочь определить, что это за металл.
Второй метод основан на проведении химического эксперимента с металлом. Для этого можно использовать различные реактивы и наблюдать, происходит ли с ними взаимодействие. Например, активные металлы могут прореагировать с соляной кислотой, выделяясь при этом водородный газ, в то время как неактивные металлы остаются инертными и не реагируют.
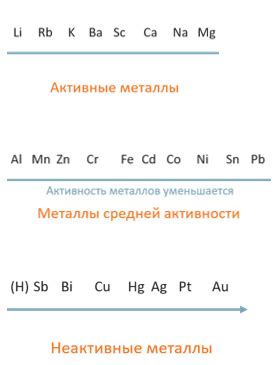
Третий метод заключается в использовании таблицы электрохимической активности металлов. В этой таблице металлы упорядочены по их активности, причем активные металлы находятся сверху, а неактивные - внизу. Это позволяет быстро и удобно определить, что это за металл. Также в таблице указывается, как металл будет реагировать с окружающей средой и другими веществами.
Активные металлы: как их распознать?

Активные металлы - это металлы, которые легко реагируют с окружающей средой и могут проявлять свойства химических элементов. Для того чтобы распознать активные металлы, следует обратить внимание на несколько ключевых признаков.
Во-первых, активные металлы активно реагируют с водой, выделяясь из нее в виде газа или образуя гидроксиды. Если при контакте с водой металл начинает шипеть и выделять пузыри, это может быть признаком активного металла.
Во-вторых, активные металлы обычно обладают ярким металлическим блеском. Они имеют характерный металлический оттенок и могут быть достаточно твердыми. Для определения активных металлов можно использовать внешний осмотр и сравнивать их внешний вид с известными активными металлами.
Также активные металлы обычно обладают низкой электроотрицательностью. Это означает, что они имеют тенденцию отдавать свои электроны в реакциях с другими веществами. Проверить электроотрицательность металла можно с помощью химических таблиц и сравнения его показателей с другими элементами.
В заключение, для распознавания активных металлов можно использовать сочетание указанных признаков: их реакцию с водой, наличие металлического блеска и низкую электроотрицательность. Комбинация этих признаков может помочь определить, является ли металл активным или неактивным.
Реакция с водой - первый признак активности

В химии существует два типа металлов: активные и неактивные. Различия между ними можно установить, проводя реакции с водой.
Активные металлы, такие как натрий, калий и магний, реагируют с водой, образуя гидроксид металла и выделяя водород. Это можно наблюдать по появлению пузырьков газа и возгоранию металла, когда он бросается в воду.
Неактивные металлы, к примеру, железо, свинец и медь, не реагируют с водой при обычных условиях. Они могут только окисляться при длительном контакте с водой, но взаимодействие между металлом и водой не будет сопровождаться выделением водорода или горением.
Этот первый признак активности металлов - их реакция с водой - можно использовать для их классификации и определения их химических свойств. Наблюдение реакций металлов с водой может помочь установить, насколько активен данный металл и предсказать его поведение в химических реакциях с другими веществами.
Кислотное тестирование - метод определения активности металла
Кислотное тестирование - это один из методов, которым можно определить активность металла. Этот метод основан на взаимодействии металла с кислотным раствором. При этом активные металлы реагируют с кислотой и выделяют газы, в то время как неактивные металлы не образуют таких реакций.
Когда активный металл взаимодействует с кислотой, он проявляет себя через образование пузырьков газа, которые можно наблюдать на поверхности металла. Это связано с активностью металла, его способностью активно взаимодействовать с окружающей средой. Например, реакция цинка с соляной кислотой приводит к образованию пузырьков водорода.
Однако, неактивные металлы не проявляют такую активность при взаимодействии с кислотами. Например, алюминий или медь не проявляют химической реакции с соляной кислотой и не выделяют газы.
Таким образом, кислотное тестирование является эффективным методом определения активности металла. После проведения этого теста можно однозначно сказать, является ли металл активным или неактивным и использовать полученную информацию для нужд научных и технических исследований.
Взаимодействие с кислородом: какая связь с активностью?

У каждого металла есть своя активность, то есть способность вступать в химические реакции, а особенно с кислородом. Это взаимодействие называется окислением. Активные металлы легко окисляются при контакте с кислородом из воздуха, в то время как неактивные металлы обычно не реагируют или вступают в реакцию очень медленно.
Активные металлы, такие как натрий, калий и магний, быстро реагируют с кислородом, образуя окиси металлов. Некоторые из них даже могут воспламеняться при контакте с кислородом. Это происходит из-за высокой электроотрицательности активных металлов, которая делает их более склонными к передаче электронов и образованию ионов.
Неактивные металлы, такие как золото, серебро и платина, практически не реагируют с кислородом в обычных условиях. Это связано с их низкой электроотрицательностью и более слабой способностью к переходу электронов.
Таблица рядов активности металлов помогает оценить их способность реагировать с кислородом и другими веществами. В верхней части таблицы находятся самые активные металлы, а в нижней - самые неактивные. Эта таблица полезна для определения активности металлов и их возможных реакций с кислородом.
Что такое электрохимический потенциал и как он связан с активностью металла?
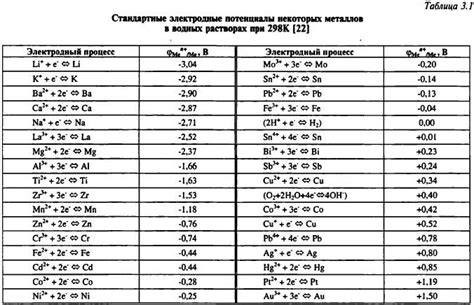
Электрохимический потенциал это физическая величина, которая характеризует способность вещества вступать во взаимодействие с электронами или ионами. Он является мерой активности металла и позволяет судить о его способности окисляться или восстанавливаться.
Металлы с более высоким электрохимическим потенциалом считаются активными, так как они легко окисляются, отдавая электроны другим веществам. Неактивные металлы, наоборот, имеют более низкий электрохимический потенциал и менее склонны к окислению.
Электрохимический потенциал каждого металла измеряется относительно стандартного водородного электрода, который имеет нулевой потенциал. Положительное значение электрохимического потенциала указывает на то, что металл склонен к окислению, а отрицательное значение говорит о его склонности к восстановлению.
Зная электрохимический потенциал металла, можно сделать вывод о его активности в реакциях окисления или восстановления. Например, если два металла имеют разные электрохимические потенциалы, то металл с более высоким потенциалом будет окисляться, а металл с более низким потенциалом будет восстанавливаться.
Практические примеры: какие металлы являются активными, а какие - неактивными?

Металлы могут быть разделены на две основные категории: активные и неактивные. Активные металлы характеризуются высокой степенью реакционности, то есть они легко вступают в химические реакции с другими веществами. Например, калий, натрий и литий – это активные металлы, которые быстро окисляются на воздухе.
Неактивные металлы, наоборот, обладают низкой степенью реакционности и не вступают в химические реакции с другими веществами так легко. Примерами неактивных металлов являются золото, серебро и платина. Они обладают высокой устойчивостью к окислению и коррозии.
В химических реакциях активные металлы обычно выделяют водород и образуют соли. Например, натрий вступает в реакцию с водой, образуя гидроксид натрия и выделяя водород. Это можно наблюдать, когда кусок натрия положить в воду – он начнет плавиться, выделяться газ и образовываться раствор натрия.
С другой стороны, неактивные металлы не вступают в реакцию с водой или воздухом, поэтому они обычно не образуют соли. Например, золото и серебро могут быть добываются в виде чистого металла из золотых или серебряных руд без необходимости реакции с другими веществами.
Таким образом, определение, является ли металл активным или неактивным, может быть важным при выборе материалов для конкретных химических реакций или процессов. Активные металлы полезны, например, для производства энергии, в то время как неактивные металлы часто используются в ювелирных украшениях и электронике.
Вопрос-ответ

Как определить, является ли металл активным или неактивным?
Для определения активности металла можно использовать несколько методов. Один из них - проведение эксперимента с железной гвоздей и различными металлическими образцами. Если после соприкосновения двух металлов на поверхности гвоздя появляются пятна или коррозия, это говорит о том, что металл активный. Если же никаких изменений не происходит, это значит металл неактивный. Также можно использовать электрохимический ряд металлов, в котором указаны значения электродных потенциалов каждого металла. Чем больше разница в значениях потенциалов двух металлов, тем больше вероятность, что один из них активный, а другой неактивный.
Какие факторы влияют на активность металла?
На активность металла влияют несколько факторов. Один из них - положение металла в электрохимическом ряду. Чем больше разница в электродных потенциалах двух металлов, тем больше вероятность, что один из них активный, а другой неактивный. Также важным фактором является среда, в которой находится металл. Некоторые металлы могут проявлять активность только в определенных условиях. Например, алюминий считается активным металлом, но в воде образуется пассивная оксидная пленка, которая защищает его от дальнейшей коррозии. Также влияние на активность металла может оказывать температура и концентрация раствора.
Какие металлы считаются активными?
Список активных металлов включает такие элементы, как калий, натрий, литий, цезий, рубидий, кальций, стронций, барий, магний, цинк, алюминий и некоторые другие. Эти металлы обладают высокой электрохимической активностью и способны реагировать с водой, кислотами и другими веществами. Они часто используются в различных областях, включая производство батареек, сплавов, коррозионностойких покрытий и др.