Оксиды металлов являются важными химическими соединениями, которые активно взаимодействуют с водородом. При этом происходит реакция, в результате которой образуются соответствующие металлы и вода. Такое взаимодействие имеет множество свойств и применений, которые находят широкое применение в различных отраслях промышленности и научных исследованиях.
Один из наиболее известных примеров реакции оксидов металлов с водородом – это преобразование гидроксида алюминия (Al2O3) с помощью водорода (H2). В результате этой реакции образуется алюминий (Al) и вода (H2O). При этом выделяется большое количество энергии, что позволяет использовать этот процесс в качестве источника тепла, например, для нагрева воды или в производстве энергии.
Оксиды металлов также обладают каталитическими свойствами, то есть они способны ускорять реакции, проходящие в их присутствии. Это свойство находит широкое применение в промышленности, например, в процессах гидрогенирования органических соединений или очистке отходов в промышленности. Кроме того, реакция оксидов металлов с водородом может применяться в производстве различных веществ, таких как сплавы, керамика, стекло и другие материалы, которые широко используются в различных отраслях промышленности и строительства.
Свойства оксидов металлов:
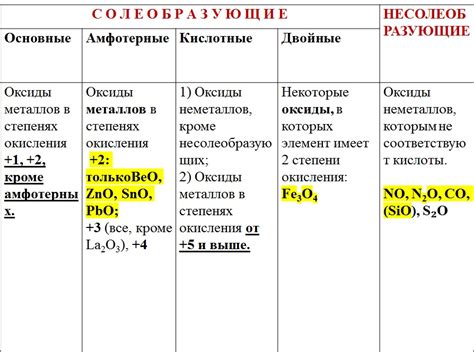
1. Химическая активность. Оксиды металлов обладают высокой химической активностью, что позволяет им легко взаимодействовать с другими веществами. Часто оксиды металлов используются в химических реакциях, таких как окисление и восстановление.
2. Растворимость. Некоторые оксиды металлов растворяются в воде, образуя щелочные растворы. Это свойство позволяет использовать оксиды металлов для получения растворов с различной кислотно-щелочной средой.
3. Физические свойства. Оксиды металлов обладают различными физическими свойствами, такими как цвет, плотность и температура плавления. Например, оксид железа (III) имеет красный цвет, а оксид алюминия - белый.
4. Кислотно-щелочные свойства. Оксиды металлов могут образовывать соли и кислоты в реакции с кислотами и основаниями. Они способны выражать свою кислотно-щелочную природу и выполнять функцию катализаторов в химических реакциях.
Реакция оксидов металлов с водородом
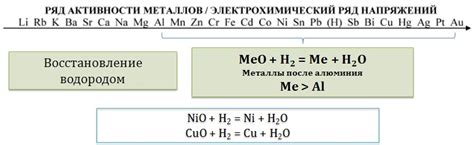
Реакция оксидов металлов с водородом – это химический процесс, при котором оксиды металлов взаимодействуют с молекулами водорода, образуя соответствующие гидроксиды металлов и выделяя воду как побочный продукт реакции.
Вода, получаемая при реакции оксидов металлов с водородом, является чистой и может быть использована в различных областях, включая промышленность, бытовые нужды и научные исследования.
Реакция оксидов металлов с водородом может происходить при нагревании оксида металла в присутствии водорода или при взаимодействии оксида металла с водородной газом в потоке.
Применение данной реакции имеет широкий спектр. Например, гидрогенолиз оксидов металлов используется в каталитических процессах для получения чистого водорода. Также реакция оксидов металлов с водородом может применяться в производстве различных химических соединений, водородных паливных элементах и даже в процессе очистки воды.
Химические свойства оксидов металлов
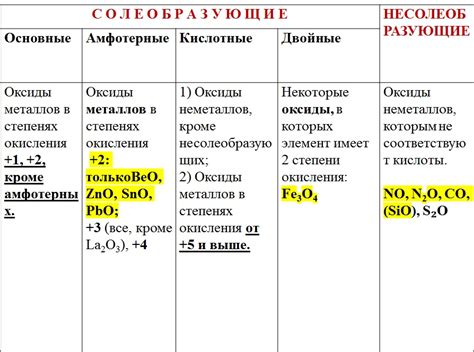
Оксиды металлов - это соединения, образованные при взаимодействии металлов с кислородом. Они характеризуются различными химическими свойствами, которые определяют их использование в различных областях.
Многие оксиды металлов обладают высокой устойчивостью и инертностью, что делает их незаменимыми материалами для создания электронных компонентов и сенсоров. Кроме того, некоторые оксиды металлов обладают полупроводниковыми свойствами, что делает их важными компонентами при производстве полупроводниковых приборов и солнечных элементов.
Оксиды металлов также широко используются в качестве катализаторов при различных химических реакциях. Например, оксиды металлов могут применяться в катализах для прямого окисления различных органических веществ, играя важную роль в производстве химических соединений и материалов.
Некоторые оксиды металлов обладают кислотными свойствами и могут взаимодействовать с веществами с щелочными свойствами. Это делает их важными компонентами для создания различных реакционных сред и реагентов. Кроме того, некоторые оксиды металлов обладают амфотерными свойствами, то есть они могут проявлять как кислотные, так и щелочные свойства, что также расширяет их область применения.
Некоторые оксиды металлов обладают специфическими свойствами, которые позволяют использовать их в различных областях. Например, оксид железа (III) обладает магнитными свойствами и может применяться для создания магнитных материалов и устройств. Оксид алюминия обладает высокой термической стойкостью и электроизоляционными свойствами, что делает его незаменимым материалом при производстве керамики, электронных компонентов и термостойких материалов.
Физические свойства оксидов металлов

Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Они обладают различными физическими свойствами, которые могут быть использованы в различных областях науки и технологии.
Внешний вид оксидов металлов может варьироваться от порошкового состояния до зернистых или кристаллических форм. Некоторые оксиды металлов имеют яркий цвет, такие как оксиды меди, которые могут быть зелеными, синими или черными. Другие оксиды, такие как оксид алюминия, имеют белый цвет.
Оксиды металлов часто обладают высокой плотностью и твердостью. Например, оксид титана является одним из самых твердых известных веществ. Однако некоторые оксиды металлов могут быть и мягкими, такими как оксид меди.
Свойства оксидов металлов также могут зависеть от их структуры. Некоторые оксиды металлов могут образовывать ионные кристаллические решетки, в то время как другие могут образовывать ковалентные связи между атомами. Это также влияет на их физические и химические свойства.
Оксиды металлов широко используются в различных областях. Например, оксид железа используется для производства стекла, красок и магнитов. Оксид алюминия используется в производстве керамики, а оксид титана используется в качестве катализатора в химической промышленности.
Применение оксидов металлов в промышленности

Оксиды металлов - это не только химические соединения, но и важные промышленные материалы, которые находят широкое применение в различных отраслях. Эти соединения обладают разными свойствами и могут иметь различные применения.
1. Катализаторы: Оксиды металлов, такие как оксид железа или оксид меди, часто используются в качестве катализаторов в различных химических реакциях. Они помогают ускорить реакцию и повысить ее эффективность. Это особенно важно в промышленности, где требуется быстрое и эффективное производство химических соединений.
2. Пигменты: Многие оксиды металлов имеют яркие и насыщенные цвета, поэтому их используют в качестве пигментов для красок, пластиков и косметических продуктов. Например, оксид железа используется в производстве красной краски, оксид титана - в производстве белой краски, а оксид кобальта - в производстве синей краски.
3. Строительные материалы: Оксиды металлов также используются в производстве различных строительных материалов. Например, оксид алюминия, который обладает высокой термической стойкостью и прочностью, используется в изготовлении огнеупорных материалов, керамической плитки и стекла.
4. Электроника: Оксиды металлов также находят применение в электронике. Например, оксид вольфрама применяется в производстве электродов для сварки и электронных ламп, а оксид цинка используется в производстве полупроводниковых устройств и светодиодов.
5. Керамика и стекло: Многие оксиды металлов имеют высокую температурную стойкость и химическую инертность, поэтому они широко применяются в производстве керамики и стекла. Оксиды таких металлов, как оксид алюминия, оксид кремния и оксид бора, используются для создания прочных и долговечных материалов для различных применений.
Таким образом, оксиды металлов имеют широкий спектр применения в различных отраслях промышленности и играют важную роль в производстве различных материалов и продуктов, которые мы используем в повседневной жизни.
Влияние оксидов металлов на окружающую среду

Оксиды металлов, образуемые в результате реакции оксидов металлов с водородом, могут оказывать значительное влияние на окружающую среду. При этом, их воздействие может быть как положительным, так и негативным в зависимости от конкретных условий эксплуатации и применения.
С одной стороны, оксиды металлов могут быть использованы в качестве катализаторов в различных процессах в промышленности и энергетике. Они способны активировать реакции и повышать скорость химических превращений. Также, некоторые оксиды металлов обладают антибактериальными свойствами, их добавление в материалы и покрытия может способствовать уничтожению микроорганизмов и предотвращать заражение.
С другой стороны, при неправильном использовании оксиды металлов могут стать источником загрязнений окружающей среды. Некоторые из них являются токсичными и могут накапливаться в почве, воде и воздухе, способствуя разрушению экосистем. Также, в процессе производства и использования оксидов металлов может выделяться вредный выброс, содержащий вредные вещества, которые могут негативно влиять на здоровье человека и животных.
Проблемы, связанные с влиянием оксидов металлов на окружающую среду, требуют серьезного внимания и контроля. Для уменьшения негативных последствий необходимо разработать и применять современные технологии очистки отходов и выбросов, а также внедрять эффективные системы контроля за содержанием вредных веществ в оксидах металлов.
Вопрос-ответ

Какие свойства имеют оксиды металлов?
Оксиды металлов обладают различными свойствами, но их общей особенностью является способность реагировать с водородом. Это обусловлено порядком восстановления, в котором металлы находятся выше в ряду реактивности, а оксиды находятся ниже.
Как происходит реакция оксидов металлов с водородом?
Реакция оксидов металлов с водородом происходит при нагревании оксида в присутствии водорода. Металлический оксид восстанавливается в металл, а вода выделяется. Это происходит из-за того, что оксид металла более активен, чем водород. Реакция может проходить между металлом и паром воды или между металлом и воздухом, если воздух содержит достаточное количество водяного пара.
