Оксиды металлов представляют собой соединения металлов с кислородом. Эти химические соединения имеют широкое применение в различных областях науки и промышленности. Каждый оксид металла имеет свои название и свойства, их классификация позволяет четко определить их химический состав и применение.
Существует несколько способов классификации оксидов металлов. Один из них основан на степени окисления металла, который может быть различным и влияет на свойства оксида. Например, оксид железа (II) и оксид железа (III) имеют разные свойства и названия. Другой способ классификации основан на структуре оксида. Они могут быть амфотерными (способными реагировать как с кислотами, так и с основаниями), основными (свойство увеличивать pH) или кислотными (свойство снижать pH).
Названия оксидов металлов имеют свою систему, основанную на числовых приставках и суффиксах. Например, оксид магния (II) обозначается как MgO, где II указывает на степень окисления металла. Оксид железа (III) обозначается как Fe2O3, где III указывает на степень окисления металла. Как правило, название оксида содержит имя металла и слово "оксид", а также приставки, указывающие на степень окисления.
Классификация оксидов металлов
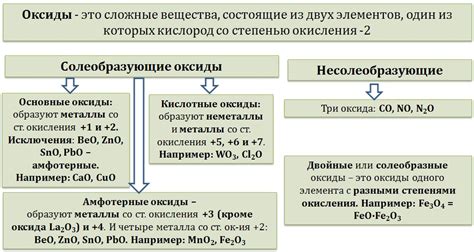
Оксиды металлов - это соединения металлов с кислородом. В зависимости от степени окисления металла они могут быть двух типов: оксиды металлов с переменной степенью окисления и оксиды металлов с постоянной степенью окисления.
Оксиды металлов с переменной степенью окисления содержат металл в нескольких степенях окисления и обычно обладают кислотными свойствами. Их названия начинаются со слова "оксид", за которым следует название металла и степень его окисления, выраженная римскими цифрами. Например, оксид железа(III) или Fe3+O2-.
Оксиды металлов с постоянной степенью окисления содержат металл только в одной степени окисления и имеют щелочные свойства. Их названия состоят из слова "оксид" и названия металла. Например, оксид натрия или Na+О2-.
Следует также отметить, что оксиды металлов могут быть различных типов: металлические, полуметаллические и неметаллические. Металлические оксиды обладают металлическими свойствами, полуметаллические оксиды обладают свойствами и металлов, и неметаллов, а неметаллические оксиды обычно обладают кислотными свойствами.
Таким образом, классификация оксидов металлов позволяет систематизировать их по свойствам и степени окисления металла, что облегчает изучение и понимание данных соединений.
Основные типы оксидов металлов
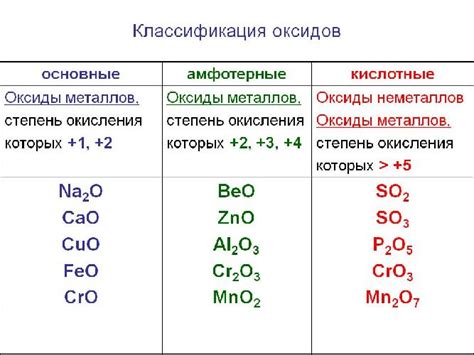
Оксиды металлов - это соединения металлов с кислородом. По своим свойствам оксиды металлов могут подразделяться на несколько основных типов.
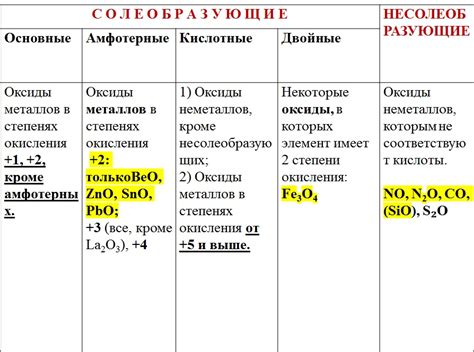
Кислотные оксиды - это оксиды металлов, которые обладают кислотными свойствами и растворяются в воде с образованием кислот. Примером такого оксида является оксид серы (IV), который образуется при сгорании серы. Кислотные оксиды имеют кислотные оксидационные свойства и обычно реагируют с основаниями, образуя соли.
Основные оксиды - это оксиды металлов, которые обладают основными свойствами. Они растворяются в воде, образуя щелочные растворы. Примером такого оксида является оксид кальция, который можно найти в некоторых минералах. Основные оксиды обычно реагируют с кислотами, образуя соли и воду.
Амфотерные оксиды - это оксиды металлов, которые могут вести себя как кислоты и как основания. Они могут растворяться как в кислотной, так и в щелочной среде. Примером такого оксида является оксид алюминия, который может реагировать как с кислотами, так и с основаниями.
Получение оксидов металлов происходит различными способами, включая сгорание металлов в кислороде, присоединение кислорода к металлу при нагревании или реакцию металла с кислотой. Оксиды металлов играют важную роль в различных отраслях промышленности, а также в природе, где могут образовываться как минералы.
Химические свойства оксидов металлов
Оксиды металлов являются химическими соединениями, состоящими из кислорода и металлического элемента. У них есть ряд характерных химических свойств, которые определяются особенностями структуры и электрических свойств самих металлов.
В первую очередь, оксиды металлов обладают щелочными свойствами. Это значит, что они реагируют с водами и образуют основания. Например, оксид натрия (Na2O) взаимодействует с водой и образует щелочь - гидроксид натрия (NaOH).
Оксиды металлов также могут действовать как кислоты. Например, оксид серы (SO2) реагирует с водой и формирует сульфитную кислоту. Это свойство часто проявляется у оксидов переходных металлов.
Оксиды металлов могут образовывать соли. Например, оксид кальция (CaO) реагирует с кислотой и образует соединение, такое как хлорид кальция (CaCl2). Соли, образованные оксидами металлов, часто широко используются в промышленности и медицине.
Некоторые оксиды металлов обладают свойствами амфотерными. Это значит, что они могут действовать как кислоты и основания одновременно. Например, оксид алюминия (Al2O3) может реагировать как с кислотами, так и с щелочами.
Одним из важных свойств оксидов металлов является их способность к окислительным и восстановительным реакциям. Они могут взаимодействовать с другими веществами и изменять степень окисления металла. Например, оксид железа (Fe2O3) может взаимодействовать с углеродом и образовывать металлическое железо.
Физические свойства оксидов металлов

Оксиды металлов обладают различными физическими свойствами, которые определяются строением и составом данных соединений. Один из важных физических параметров, характеризующих оксиды металлов, это их температура плавления. В зависимости от металла, с которым связан кислород, и степени окисления металла, температура плавления оксидов может сильно варьировать. Например, оксид свинца (PbO) имеет температуру плавления около 888 градусов Цельсия, а оксид алюминия (Al2O3) плавится только при температуре более 2000 градусов Цельсия.
Еще одним важным физическим свойством оксидов металлов является их способность проводить электричество. Многие оксиды металлов обладают полупроводниковыми свойствами, то есть они способны проводить электрический ток лишь при определенных условиях. Например, оксид кремния (SiO2) является одним из наиболее распространенных полупроводников. В то же время, некоторые оксиды, например оксид меди (Cu2O), обладают металлическими свойствами и могут проводить электричество даже при обычных условиях.
Также стоит отметить, что оксиды металлов обычно обладают высокой твердостью. Это связано с их кристаллической структурой и химическим соединением, которое формирует кислород с металлом. Некоторые оксиды, например оксид железа (Fe2O3), обладают магнитными свойствами и могут быть использованы в производстве магнитов и других электронных устройств.
Вопрос-ответ

Какие существуют классификации оксидов металлов?
Существует несколько классификаций оксидов металлов. Одна из них основана на валентности металла, вторая - на свойствах оксиона. По валентности металла оксиды делятся на монооксиды (оксиды, содержащие один атом металла), диоксиды (содержащие два атома металла), трехоксиды (содержащие три атома металла) и так далее. По свойствам оксиона оксиды металлов делятся на алюминаты, ферриты, магнетиты и другие.
Какие свойства имеют оксиды металлов?
Оксиды металлов обладают различными свойствами в зависимости от самого металла и условий синтеза. Они могут быть твердыми, жидкими или газообразными веществами. Некоторые оксиды обладают высокой термической и электрической проводимостью, другие – магнитными свойствами. Также оксиды металлов могут иметь кислотные, основные или амфотерные свойства в зависимости от их взаимодействия с кислотами и щелочами.
