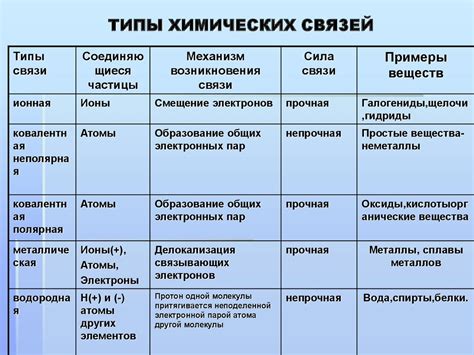
Химическая связь - это явление, при котором атомы объединяются в молекулы или кристаллы. Такие связи возникают в результате взаимодействия электронов во внешней электронной оболочке атомов. В химии выделяют несколько основных типов химических связей: ионную, ковалентную, неполярную, полярную и металлическую.
Ионная связь образуется между атомами, один из которых отдает, а другой принимает электроны. В результате образуется электрически нейтральное соединение, состоящее из положительно и отрицательно заряженных ионов. Примерами ионных связей являются соединения между металлами и неметаллами, такие как хлорид натрия (NaCl) и сульфат магния (MgSO4).
Ковалентная связь возникает, когда два атома делят электроны в своих внешних оболочках. В результате образуется молекула, в которой атомы стабилизируются за счет общего использования электронов. Примерами ковалентных связей являются молекулы кислорода (O2) и воды (H2O).
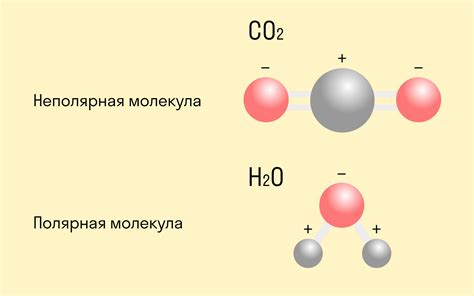
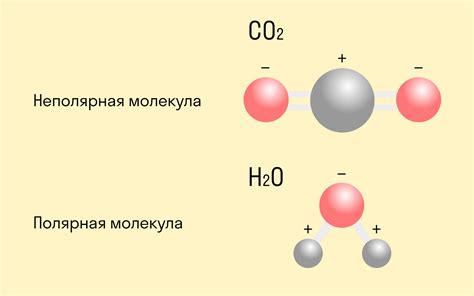
Неполярная связь возникает, когда электроны в молекуле распределены равномерно. Это происходит, когда у атомов одинаковая электроотрицательность. Примером неполярной связи является молекула метана (CH4), где балансируются положительный и отрицательный заряды атомов углерода и водорода.
Полярная связь возникает, когда электроны в молекуле распределены неравномерно из-за разницы в электроотрицательности атомов. В результате образуются положительно и отрицательно заряженные части молекулы. Примером полярной связи является молекула воды (H2O), где атом кислорода сильнее притягивает электроны и образует отрицательный заряд, а атомы водорода образуют положительный заряд.
Металлическая связь возникает в металлах и характеризуется перемещением электронов между атомами. В результате образуется сеть положительно заряженных ионов металла, окруженных «облаком» свободных электронов. Примерами металлических связей являются свинец (Pb), железо (Fe) и медь (Cu).
Типы химических связей
Химическая связь – это силы, которые удерживают атомы в молекуле или ионе. Существуют различные типы химических связей, каждый из которых обусловлен определенными условиями и взаимодействиями атомов.
Ионная связь возникает между металлическим и неметаллическим атомами. В такой связи заряженные ионы притягиваются друг к другу противоположными зарядами. Ионная связь является очень крепкой и обеспечивает образование кристаллических сеток ионных соединений, таких как соль и минералы.
Ковалентная связь возникает при обмене электронами между атомами. При ковалентной связи электроны образуют общие пары, которые являются общей собственностью обоих атомов. Ковалентные связи обладают средней прочностью и обычно образуют молекулы, такие как вода и углекислый газ.
Неполярная связь возникает между атомами, имеющими одинаковую электроотрицательность. В таком случае электроны общих пар равномерно распределены между атомами. Неполярные связи характерны для молекул, состоящих из одинаковых атомов, таких как молекулы кислорода и азота.
Полярная связь возникает между атомами с различной электроотрицательностью, что приводит к неравномерному распределению электронов. В результате одна сторона молекулы приобретает отрицательный заряд, а другая - положительный. Полярные связи обладают средней прочностью и присутствуют в молекулах, содержащих атомы разных элементов, таких как молекулы воды и аммиака.
Металлическая связь образуется между металлическими атомами. В такой связи электроны свободно перемещаются между атомами, создавая множество дефективных уровней энергии. Металлическая связь обладает очень высокой прочностью, что обуславливает особые свойства металлов, такие как хорошая электропроводность и пластичность.
Ионная связь

Ионная связь - это тип химической связи между атомами, основанный на образовании ионов положительного и отрицательного заряда. В ионной связи происходит перенос электронов от одного атома к другому, что приводит к образованию положительных и отрицательных ионов.
Ионная связь часто образуется между металлами и неметаллами, так как металлы имеют тенденцию отдавать электроны, создавая положительные ионы, а неметаллы имеют тенденцию принимать электроны, создавая отрицательные ионы. При взаимодействии этих ионов происходит электростатическое притяжение, что и образует ионную связь.
Ионная связь обладает следующими характеристиками:
- Очень сильная: ионная связь является одной из самых сильных химических связей.
- Хрупкость: ионная решетка, образованная ионами, обычно легко разрушается при воздействии внешних факторов.
- Постоянная длина связи: ионная связь имеет определенную длину, которая зависит от радиуса ионов и их заряда.
- Твёрдотельное состояние: множество веществ с ионной связью образуют твёрдые кристаллические структуры.
- Высокие температуры плавления и кипения: твёрдые вещества с ионной связью обычно имеют очень высокие температуры плавления и кипения.
Примерами веществ, образующих ионную связь, являются хлорид натрия (NaCl), оксид кальция (CaO), сульфат магния (MgSO4) и многие другие.
Ковалентная связь
Ковалентная связь - это тип химической связи между атомами, основанный на общем использовании электронных пар. В ковалентной связи электроны разделяются между атомами и образуют области общего электронного облака, которое удерживает атомы вместе.
Ковалентная связь обычно образуется между неметаллическими элементами, которые имеют высокую электроотрицательность. В процессе образования ковалентной связи каждый атом вносит свои электроны в общий пул, что позволяет обоим атомам достичь устойчивой электронной конфигурации.
Ковалентные связи могут быть одинарными, двойными или тройными, в зависимости от числа электронных пар, которые разделяют атомы. Одинарная ковалентная связь образуется при обмене одной электронной пары, двойная - при обмене двух электронных пар, а тройная - при обмене трех электронных пар.
Свойства веществ, образованных ковалентными связями, зависят от характера и числа ковалентных связей. Ковалентные соединения обычно обладают низкой теплопроводностью и температурой плавления, так как межатомные связи в них слабы. Ковалентная связь также может обладать полярностью, когда электроны в общем электронном облаке распределены неравномерно между атомами, что приводит к возникновению дипольного момента.
Неполярная связь

Неполярная связь – это тип химической связи, который образуется между атомами, у которых электроотрицательности практически одинаковы или очень близки. В такой связи электроны равномерно распределены между атомами и не создают положительных и отрицательных зарядов. Такие связи часто образуются между атомами одного и того же химического элемента.
Неполярные связи обычно формируются между неметаллами или между углеродными атомами в органических соединениях. Они характеризуются равномерным распределением электронной плотности и отсутствием дипольного момента. Это означает, что такие соединения не обладают полярностью и не образуются заряды внутри молекулы.
Примером неполярной связи может служить ковалентная связь между двумя атомами водорода, или между атомами углерода в молекуле метана. В этих случаях электроны равномерно распределены между атомами и молекулы не обладают никаким положительным или отрицательным зарядом.
Неполярные связи играют важную роль в химии и в природе. Они способствуют образованию молекул и стабильности соединений. Также они могут влиять на физические свойства веществ, такие как температура плавления и точка кипения.
Полярная связь
Полярная связь - это химическая связь, в которой электроны между атомами не равномерно распределены, создавая положительный и отрицательный полюса. Основной механизм полярной связи - разность в электроотрицательности атомов, которая приводит к неравномерному притяжению электронов.
В полярной связи электроны проводимости переносятся от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью, создавая положительный полюс у атома с большей электроотрицательностью и отрицательный полюс у атома с меньшей электроотрицательностью.
Некоторые примеры веществ с полярной связью включают молекулы воды (H2O), где кислородный атом с большей электроотрицательностью создает отрицательный полюс, а атомы водорода - положительный полюс. Однако существуют и молекулы, в которых полярность не так очевидна, например, углекислый газ (CO2), где электроотрицательности атомов углера и кислорода близки, но положительные и отрицательные полюса все равно образуются за счет симметрии молекулы и разности расположения атомов.
Полярная связь имеет важное значение во многих химических и физических явлениях, таких как сольватация, растворение и межмолекулярное взаимодействие. Она также играет ключевую роль в определении свойств вещества, таких как его растворимость, температура плавления и кипения, силы взаимодействия и многое другое.
Металлическая связь

Металлическая связь - это тип химической связи, который существует между атомами металлов. В металлической связи электроны, находящиеся в валентной оболочке этих атомов, образуют общий электронный облако. Этот тип связи отличается от остальных тем, что в нем электроны могут двигаться свободно по всему металлу.
Металлическая связь является причиной таких свойств металлов, как высокая теплопроводность и электропроводность. Общее электронное облако создает сильные электростатические привлекательные силы между атомами металла, что делает металлы твердыми при комнатной температуре.
Кроме того, металлическая связь обуславливает способность металлов к подвижности и деформации. Электроны могут легко перемещаться по всему металлическому кристаллу, что позволяет металлам быть гибкими и деформируемыми без разрушения связей между атомами.
Металлические связи могут быть разной силы и уровнями проводимости, в зависимости от типа металла и структуры его кристаллической решетки. Некоторые металлы образуют шарнирные, а не ковалентные связи, что делает их еще более подвижными и разрешает проявление металлического блеска.
Вопрос-ответ

Что такое химическая связь?
Химическая связь – это взаимодействие атомов, ионов или молекул, которое обусловливает их удерживание вместе и образует структуру вещества.
Какие типы химических связей существуют?
Существуют несколько типов химических связей: ионная, ковалентная, полярная, неполярная и металлическая связи.
В чем заключается различие между ионной и ковалентной связью?
В ионной связи происходит полный или частичный перенос электронов между атомами, что приводит к образованию ионов с противоположными зарядами. Ковалентная связь образуется при равном или близком разделении электронов между атомами, образуя молекулу.
