Металлы побочных подгрупп являются важными элементами в химии. Их валентность играет ключевую роль в определении их химических свойств и реакций. Валентность металлов побочных подгрупп зависит от радиуса атома, электронной конфигурации и степени окисления. Определение валентности металлов побочных подгрупп может помочь в понимании их реакционной способности и связанной с этим химической активности.
Для определения валентности металлов побочных подгрупп необходимо учитывать несколько факторов. Во-первых, радиус атома металла играет важную роль. Большой радиус у металла обычно указывает на низкую валентность, так как электроны могут легко перемещаться внутри металлической решетки. С другой стороны, малый радиус может указывать на более высокую валентность, так как электроны могут быть сильнее привязаны к ядру.
Второй фактор, влияющий на валентность металлов побочных подгрупп, - электронная конфигурация. Электронная конфигурация определяет количество внешних электронов, которые металл может потерять или принять во время реакции. Металлы побочных подгрупп с полузаполненными или полностью заполненными внутренними энергетическими уровнями, такими как д-блок, могут иметь низкую валентность из-за стабильности этих внутренних электронных конфигураций.
Определение валентности металлов побочных подгрупп
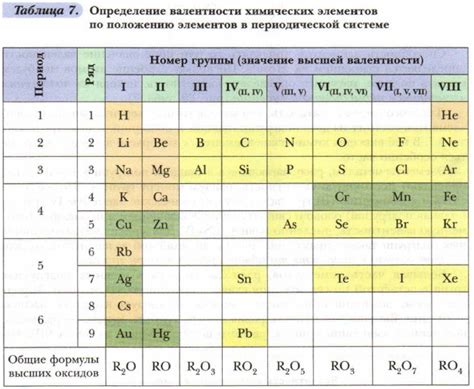
Определение валентности металлов побочных подгрупп является важной задачей в химической аналитике. Валентность металлов определяет количество электронов, которые металл может отдать или принять при образовании химических связей. Знание валентности металлов побочных подгрупп помогает определить, какие соединения может образовывать данный металл и какие свойства они будут иметь.
Для определения валентности металлов побочных подгрупп следует учитывать несколько факторов. Во-первых, необходимо изучить электронную конфигурацию атома металла. Валентная электронная оболочка, состоящая из наиболее удаленных от ядра электронов, определяет валентность металла. Во-вторых, следует рассмотреть окислительно-восстановительные свойства металла. Металлы, способные отдавать электроны, имеют положительную валентность, а металлы, способные принимать электроны, имеют отрицательную валентность.
Существует также таблица валентности металлов побочных подгрупп, которая облегчает определение валентности. В таблице указывается валентность каждого металла в виде римских цифр. Например, медь имеет валентность II, что означает, что она может отдать два электрона для образования соединений. Алюминий имеет валентность III, что означает, что он может отдать три электрона. Эта таблица является хорошим справочным материалом для определения валентности металлов побочных подгрупп.
Металлы побочных подгрупп и их свойства

Металлы побочных подгрупп являются химическими элементами, которые находятся в периодической системе химических элементов между металлами основных подгрупп и неметаллами. Они обладают рядом уникальных свойств и валентностью, определение которой является важным аспектом для изучения химии и промышленности.
Одним из наиболее известных металлов побочных подгрупп является медь (Cu). Она имеет атомный номер 29 и химический символ Cu. Медь обладает высокой электропроводностью, химической устойчивостью и прекрасными антикоррозионными свойствами. Медь в основном производится путем обогащения природных руд и используется в различных отраслях, включая электротехнику, строительство и медицину.
Еще одним важным металлом побочной подгруппы является свинец (Pb). Свинец имеет атомный номер 82 и химический символ Pb. Он обладает низкой температурой плавления, хорошей устойчивостью к коррозии и мягкой текстурой. Свинец широко применяется в аккумуляторах, медицинском оборудовании и в производстве кабелей и покрытий.
Еще одним интересным металлом побочной подгруппы является свинец (Hg). Ртуть имеет атомный номер 80 и химический символ Hg. Она является жидким при комнатной температуре и обладает высокой плотностью. Ртуть широко используется в научных исследованиях, электронике и производстве термометров.
Методы определения валентности металлов побочных подгрупп
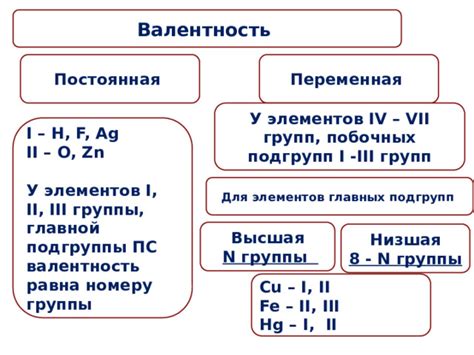
Определение валентности металлов побочных подгрупп является важным этапом в изучении химических свойств этих элементов. Существуют различные методы, позволяющие определить валентность металлов побочных подгрупп, включая спектроскопические и химические методы.
Один из спектроскопических методов - рентгеноструктурный анализ. Данный метод позволяет определить расположение атомов в кристаллической решетке металла и тем самым выявить его валентность. С помощью рентгеноструктурного анализа можно исследовать металлы побочных подгрупп с различными валентностями и сравнить их свойства.
Химические методы также широко применяются для определения валентности металлов побочных подгрупп. Один из таких методов - окислительно-восстановительная титровка. В рамках данного метода металл в соединении окисляется или восстанавливается с помощью окислителя или восстановителя, исходя из чего можно сделать выводы о его валентности.
Другим химическим методом является электрохимический анализ. Этот метод основан на измерении электрической потенциальной разности между отдельными электродами, включающими металл побочной подгруппы. Из полученных данных можно определить валентность металла и его химическую активность.
Определение валентности металлов побочных подгрупп является важной задачей при проведении лабораторных исследований и имеет большое значение для понимания их химических свойств и возможностей применения в различных отраслях науки и техники.
Примеры определения валентности металлов побочных подгрупп

Медь (Cu)
Для определения валентности меди в соединении, следует рассмотреть ее ионный заряд в различных соединениях. Например, в соединении хлорида меди (CuCl2), ион меди имеет заряд +2. Поэтому медь в данном соединении имеет валентность +2. В другом соединении, например, оксида меди (CuO), ион меди имеет заряд +1, следовательно, валентность меди равна +1.
Свинец (Pb)
Для определения валентности свинца также необходимо рассмотреть его ионный заряд в различных соединениях. Вряд ли можно определить валентность свинца исключительно по его названию. Например, в соединении оксида свинца (PbO2), ион свинца имеет заряд +4. Поэтому свинец в данном соединении имеет валентность +4. В хлориде свинца (PbCl2), ион свинца имеет заряд +2, следовательно, валентность свинца равна +2.
Железо (Fe)
Железо может иметь различные валентности в различных соединениях. Например, в хлориде железа (FeCl2) ион железа имеет заряд +2, поэтому валентность железа равна +2. В оксиде железа (Fe2O3) ионы железа имеют разные заряды: +3 и -2, соответственно, валентность железа равна +3.
Таким образом, определение валентности металлов побочных подгрупп осуществляется на основе рассмотрения ионных зарядов данных металлов в различных соединениях, что позволяет установить их актуальную валентность.
Вопрос-ответ

Как определить валентность металлов побочных подгрупп?
Валентность металлов побочных подгрупп можно определить, исходя из их электронной конфигурации. Для этого необходимо знать количество электронов во внешней оболочке атома металла, которое можно определить по его порядковому номеру в таблице Менделеева. Например, металлы из II побочной подгруппы имеют валентность +2, поскольку в их внешней оболочке находятся два электрона.
Как определить валентность металлов побочных подгрупп, если их электронная конфигурация неизвестна?
Если электронная конфигурация металла неизвестна, валентность можно определить на основе сравнения металлов с известной валентностью. Например, если один металл имеет валентность +2, а другой - +3, то можно сделать вывод, что первый металл находится в более низком окислительном состоянии (имеет более низкую валентность). Для более точных определений необходимо обращаться к химическим справочникам и таблицам валентности.
