Металлы являются одними из основных химических элементов, которые активно взаимодействуют с растворами кислот. Это взаимодействие может протекать различными способами и иметь различные последствия. Металлы могут растворяться в кислотах, образуя соли и выделяя газы, такие как водород. Они также могут образовывать оксиды и гидроксиды при взаимодействии с кислотами. В данной статье рассмотрим особенности взаимодействия различных металлов с растворами кислот и описываемые реакции.
Одной из наиболее распространенных реакций металлов с кислотами является образование солей. Эта реакция протекает путем замещения водорода в кислоте металлом. Например, при взаимодействии железа с серной кислотой образуется сульфат железа. Такие реакции могут быть использованы для получения солей различных металлов.
Многие металлы, такие как цинк, алюминий и магний, образуют оксиды при взаимодействии с кислотами. Эти оксиды обладают особенностями, которые могут быть использованы в отрасли. Например, оксид цинка является важным сырьем для производства резиновых и пластиковых изделий. Поэтому взаимодействие таких металлов с кислотами имеет не только химическое, но и практическое значение.
Важно отметить, что степень активности металлов в реакции с кислотами может зависеть от их электрохимического потенциала, концентрации кислоты и других факторов. Например, некоторые металлы, такие как золото и платина, обладают низкой активностью и протекающие с ними реакции с кислотами проходят медленно или вообще не происходят.
Таким образом, взаимодействие металлов с растворами кислот является важной областью исследований в химии. Оно имеет широкие практические применения и может быть использовано для получения солей и оксидов, а также для изучения особенностей химических реакций. Познание этих особенностей позволяет нам лучше понять мир вокруг нас и использовать его ресурсы эффективно.
Влияние кислот на металлы: особенности и реакции
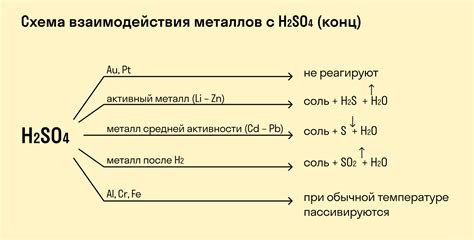
Металлы являются активными элементами, которые способны взаимодействовать с различными веществами, в том числе с растворами кислот. Кислоты обладают способностью отдавать протоны, что приводит к процессу окисления металлов.
Особенности взаимодействия металлов с кислотами определяются как свойствами кислот, так и свойствами металлов. Кислоты, содержащие сильные окислители, могут вызывать более интенсивные реакции с металлами. Также влияние кислот на металлы может зависеть от их концентрации и температуры раствора.
Реакции металлов с кислотами проходят с образованием солей и выделением газа – это одна из наиболее характерных особенностей данных взаимодействий. Газ, выделяющийся в результате реакции, может быть идентифицирован по запаху или путем проведения особых тестов.
При взаимодействии металлов с кислотами важную роль играют также электрические свойства металлов и кислот. Металлы обладают способностью проводить электрический ток и активно участвуют в реакции окисления, а кислоты способны повлиять на потенциал окислительно-восстановительного потенциала металлов.
Процессы взаимодействия
Взаимодействие металлов с растворами кислот представляет собой химический процесс, в ходе которого металл образует соли, выпадающие в виде осадка. Взаимодействие осуществляется посредством реакций окисления-восстановления, при которых электроны передаются от металла к кислороду.
Одной из особенностей взаимодействия металлов с кислотами является образование водорода. При реакции некоторых металлов с кислотами выделяется обильное количество водорода, что делает этот процесс заметным. Это связано с тем, что восстановленный водород образует газообразные пузырьки, воспринимаемые глазом.
Процессы взаимодействия металлов с растворами кислот могут протекать с разной скоростью в зависимости от свойств металла и концентрации кислоты. Некоторые металлы, такие как цинк или алюминий, способны реагировать с растворами кислот более активно, выделяя водород и образуя соли. Другие металлы, например, золото или серебро, имеют меньшую активность и могут образовывать соединения с более слабым окислителем.
| Металл | Реакция с кислотой |
|---|---|
| Цинк (Zn) | Zn + 2HCl → ZnCl2 + H2 |
| Алюминий (Al) | 2Al + 6HCl → 2AlCl3 + 3H2 |
| Золото (Au) | Au + 4HCl → AuCl4- + 3H2 |
При взаимодействии металлов с кислотами может также происходить образование растворимых веществ, которые могут растворяться в воде без образования осадков. Например, реакция меди (Cu) с растворами соляной кислоты приводит к образованию хлорида меди(II), который легко диссоциирует в воде, образуя ионы меди и хлора:
Cu + 2HCl → CuCl2 + H2
Таким образом, взаимодействие металлов с растворами кислот имеет различные особенности, которые определяются свойствами металла и его активностью. Эти процессы активно применяются в различных областях науки и промышленности.
Что такое кислоты и их свойства

Кислоты - это химические соединения, которые обладают способностью выделять ион водорода (H+) в растворе. Они имеют кислотный вкус и могут действовать на растительное и животное вещество.
Одно из основных свойств кислоты - это ее кислотность, которая указывает на количество ионов водорода в растворе. Кислотность измеряется с помощью pH метра и колеблется от 0 до 14. А значением pH ниже 7 является кислотное растворение.
Кислоты могут иметь разные степени кислотности. Они могут быть сильно кислотными (например, соляная кислота) или слабо кислотными (например, уксусная кислота). Сильные кислоты имеют малую константу диссоциации и высокую степень ионизации. Они эффективно выделяют ионы водорода в растворе. Слабые кислоты, напротив, имеют большую константу диссоциации и меньшую степень ионизации, что делает их менее эффективными при выделении ионов водорода.
Свойства кислот включают реакцию с основаниями, металлами и некоторыми неметаллами. Кислоты могут реагировать с основаниями, образуя соль и воду. Они также могут реагировать с металлами, образуя соли и выделяя ион водорода. Некоторые кислоты могут реагировать с неметаллами, образуя газы или другие соединения.
Примеры кислот включают соляную кислоту (HCl), серную кислоту (H2SO4) и уксусную кислоту (CH3COOH). Эти кислоты широко используются в промышленности и научных исследованиях, а также в повседневной жизни.
Взаимодействие кислот с металлами
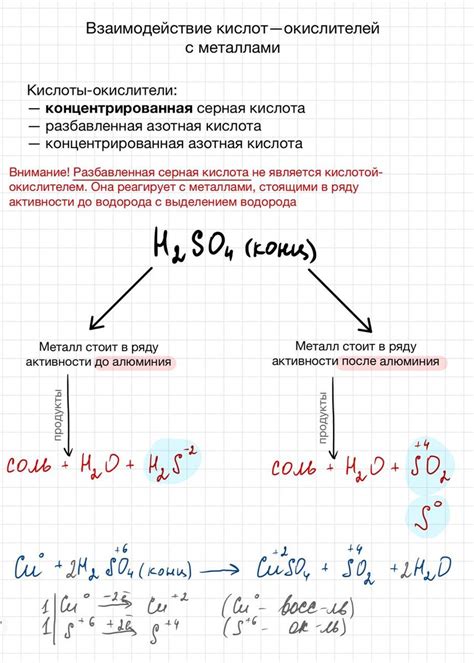
Взаимодействие кислот с металлами – важный процесс, изучаемый в химии. Кислоты, такие как серная кислота, соляная кислота и уксусная кислота, способны реагировать с различными металлами, вызывая химические реакции.
При контакте кислоты с металлом происходит образование соли и выделение водорода. В реакции металл обладает активностью, определяющей скорость реакции и степень его растворения в кислоте. Активность металлов можно оценить с помощью электрохимического ряда или ряда напряжений.
Некоторые металлы, например, медь и серебро, мало реактивны и практически не взаимодействуют с сильными кислотами, такими как серная и соляная. Металлы, такие как цинк и алюминий, реагируют со средней активностью и способны выделять водород при контакте с кислотами.
Существуют также металлы, обладающие высокой активностью, которые реагируют с кислотами очень быстро и интенсивно. К ним относятся щелочные металлы, такие как натрий и калий. При взаимодействии с водной средой эти металлы могут вызывать выделение водорода и образование щелочей.
Изучение взаимодействия кислот с металлами является важным не только с точки зрения теории, но и имеет практическое значение. Например, знание реакций металлов с кислотами позволяет предсказывать возможность образования определенного продукта, контролировать реакции в лаборатории или производстве, а также применять металлы и кислоты в различных отраслях промышленности и научных исследованиях.
Разновидности реакций

Взаимодействия металлов с растворами кислот могут протекать по нескольким разновидностям реакций. Одной из наиболее распространенных является окислительно-восстановительная реакция, в которой металл переходит из органического состояния в неорганическое и наоборот.
Кроме того, реакции металлов с кислотами могут протекать по реакций образования солей. В этом случае образуется соль металла и кислоты, при этом выделяется вода. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению воды.
Некоторые металлы могут реагировать с кислородом из воздуха во время взаимодействия с кислотами. В результате формируются соответствующие оксиды металлов. Например, реакция железа с серной кислотой приводит к образованию железного (II) сульфата и выделению диоксида серы.
Также металлы могут реагировать с кислородом из кислоты, образуя соответствующие оксиды. Например, алюминий при взаимодействии с соляной кислотой образует дихлорид алюминия и выделяет воду.
В редких случаях, при взаимодействии металла и кислоты, может происходить образование газа. Например, при реакции цинка с соляной кислотой выделяется водород. Этот тип реакции может быть использован для диагностики металлов, так как газ можно обнаружить по его особенностям, например, по горению водорода воздухе.
Коррозия металлов

Коррозия металлов – это процесс разрушения их под действием окружающей среды. Он является одной из основных проблем, связанных с эксплуатацией и сохранением металлических конструкций.
Главными причинами коррозии металлов являются взаимодействие с влагой и кислородом, а также наличие электрохимических потенциалов.
При коррозии металла на его поверхности образуется тонкий слой окиси, который физически не связан с металлом и служит преградой для дальнейшего разрушения. Однако, в процессе коррозии окислитель разрушается, а металл приходит в кислотную среду, что ускоряет процесс разрушения.
Коррозионная стойкость металлов зависит от их химического состава, структуры, условий окружающей среды и наличия защитных покрытий. В большинстве случаев, металлы с высокой коррозионной стойкостью, такие как алюминий или нержавеющая сталь, применяются в условиях, где взаимодействие с окружающей средой неизбежно.
Для защиты металлов от коррозии используются различные методы, включая нанесение защитных покрытий, использование антикоррозийных добавок, электрохимическую защиту и другие. Знание особенностей коррозии и методов ее предотвращения необходимо для обеспечения долговечности металлических конструкций и устройств.
Защита от коррозии
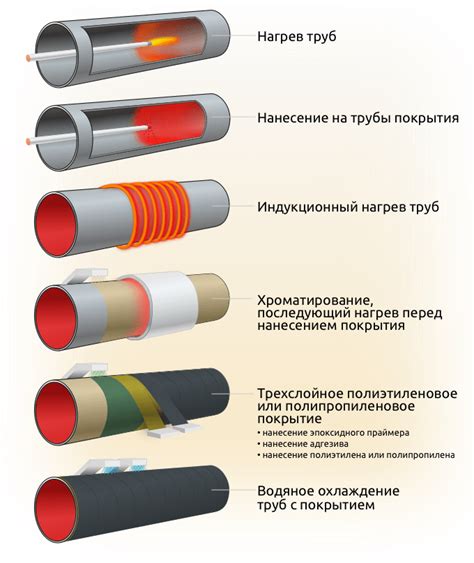
Коррозия – это процесс разрушения металла под действием воздействия внешних факторов, таких как кислоты, влага и другие химические соединения. Чтобы защитить металл от коррозии, применяются различные методы.
Один из способов защиты – нанесение защитных покрытий на поверхность металла. Эти покрытия могут быть физическими или химическими. Физические покрытия, например, пленки из полимеров или эмали, образуют защитный барьер между металлом и внешней средой. Химические покрытия, такие как оксиды или фосфаты, создают на поверхности металла тонкую защитную пленку, препятствующую дальнейшей коррозии.
Другим способом защиты от коррозии является использование антикоррозионных добавок. Эти добавки могут быть добавлены к растворам кислот, которые взаимодействуют с металлом. Например, в растворы кислоты можно добавить ингибиторы коррозии – вещества, уменьшающие скорость коррозионного процесса. Ингибиторы образуют на поверхности металла защитную пленку, которая предотвращает воздействие кислоты на металл.
Еще одним методом защиты от коррозии является использование анодной защиты. При этом методе на металлическую конструкцию подается постоянный электрический ток, который защищает металл от коррозии. Ток создает на поверхности металла электрический потенциал, который предотвращает окисление металла.
В целом, выбор метода защиты от коррозии зависит от условий эксплуатации металлической конструкции и химических свойств взаимодействующих с ней веществ. Коррозия может привести к серьезным последствиям, поэтому важно принять необходимые меры по защите металла от негативного воздействия окружающей среды.
Примеры реакций металлов с растворами кислот
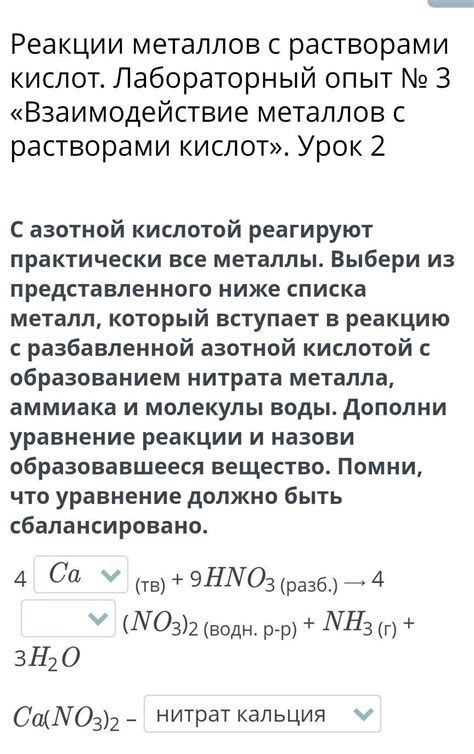
1. Реакция металла с соляной кислотой:
2HCl + Zn → ZnCl2 + H2
В результате реакции металл цинк вступает в реакцию с соляной кислотой, образуя хлорид цинка и выделяя водород.
2. Реакция металла с серной кислотой:
H2SO4 + 2Na → Na2SO4 + H2
При взаимодействии металла натрия с серной кислотой образуется сульфат натрия и выделяется водород.
3. Реакция металла с азотной кислотой:
3HNO3 + Fe → Fe(NO3)3 + NO + 2H2O
При реакции металла железа с азотной кислотой образуется нитрат железа, выделяются оксид азота и вода.
4. Реакция металла с уксусной кислотой:
2CH3COOH + Zn → (CH3COO)2Zn + H2
Металл цинк взаимодействует с уксусной кислотой, образуя ацетат цинка и выделяя водород.
5. Реакция металла с фосфорной кислотой:
H3PO4 + 3Ca → Ca3(PO4)2 + 3H2
При взаимодействии металла кальция с фосфорной кислотой образуется фосфат кальция и выделяется водород.
Таким образом, реакции металлов с растворами кислот имеют свои особенности и могут протекать с образованием солей и выделением водорода или других продуктов.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Реакция металлов с кислотами зависит от их активности. Активные металлы, такие как натрий и калий, реагируют с большинством кислот, в том числе с сильными, например соляной и серной. Менее активные металлы, такие как магний и алюминий, реагируют только с некоторыми кислотами, например соляной и серной, но не реагируют с азотной. Неактивные металлы, такие как железо и медь, обычно не реагируют с кислотами.
Какие реакции происходят при взаимодействии металлов с кислотами?
При реакции металлов с кислотами образуются соли и выделяется водород. Соли образуются в результате замены водорода в кислоте на металл. Например, при реакции цинка с соляной кислотой образуется соль цинка и выделяется водород. Уравнение реакции: Zn + 2HCl → ZnCl2 + H2.
Какие реакции происходят при взаимодействии активных металлов с соляной кислотой?
При взаимодействии активных металлов, таких как натрий или калий, с соляной кислотой происходит быстрая и интенсивная реакция. В результате образуется соль и выделяется большое количество водорода. Например, при реакции натрия с соляной кислотой образуется соль хлорида натрия и выделяется водород. Уравнение реакции: 2Na + 2HCl → 2NaCl + H2.
Что происходит при взаимодействии металлов с сильными кислотами?
При взаимодействии металлов с сильными кислотами, такими как соляная или серная, происходит активная реакция с выделением большого количества водорода. Металл замещает водород в кислоте и образует соль, при этом выделяется водородный газ. Например, при реакции цинка с соляной кислотой образуется соль цинка и выделяется водород. Уравнение реакции: Zn + 2HCl → ZnCl2 + H2.
