Металлическая связь - одна из основных типов химической связи, которая происходит между атомами металлов. Она отличается от ионной связи и ковалентной связи, так как в металлической связи между атомами металла образуются общие электронные пары.
Металлы обладают способностью отдавать один или более электронов своей внешней оболочки. За счет этого образуются общие электронные пары, которые образуют облако электронов вокруг положительно заряженных ионов металлов. Электроны в этом облаке свободно движутся между атомами, создавая так называемую электронную оболочку.
Электроны в металлической связи могут передвигаться в облаке свободно и, благодаря своему движению, способны проводить электрический ток. Именно поэтому металлы являются хорошими проводниками электричества. Кроме того, электроны в металлической связи также могут передавать и тепло, делая металлы хорошими теплопроводниками.
Электронные пары и связывание атомов
Металлическая связь - это способ связывания атомов металла, который обеспечивает его основные химические и физические свойства. Основной механизм металлической связи заключается в образовании общих электронных пар между атомами металла.
Общие электронные пары представляют собой электроны, которые свободно перемещаются внутри металлической структуры, не принадлежащие ни к одному конкретному атому. Эти электроны образуют электронное облако, которое окружает атомы металла.
Образование общих электронных пар возникает из-за особенностей электронной структуры атомов металла. В отличие от атомов неметаллов, у атомов металлов в внешнем электронном слое обычно находятся меньше электронов, чем имеется свободных мест для заполнения. Поэтому атомы металла ищут способ образования дополнительных связей с другими атомами для достижения стабильности.
В результате образуется кристаллическая решетка металла, в которой атомы металла расположены в регулярном порядке и образуют сферические структуры. Общие электронные пары между атомами металла обеспечивают силу связи и позволяют атому обрести стабильность.
Роль металлической связи

Металлическая связь является одним из основных типов химических связей, которые обеспечивают структурную и электронную устойчивость металлических материалов. Она играет важную роль в формировании свойств металлов и способствует их характерным свойствам, таким как электрическая и теплопроводность, пластичность и прочность.
Металлическая связь основана на общих электронах, которые связывают атомы металлов в кристаллической решетке. Общие электроны образуют так называемые "море электронов", которые свободно двигаются по всему объему материала. Это создает структуру сильно связанных положительных ионов металла и свободно движущихся электронов. Такая структура обуславливает типичное металлическое поведение.
Металлическая связь обладает несколькими важными свойствами. Во-первых, она является очень сильной, что делает металлы твердыми и прочными. Во-вторых, она обладает высокой электропроводностью и теплопроводностью благодаря свободному движению электронов. В-третьих, металлическая связь позволяет материалу быть пластичным и деформируемым без разрушения, что делает его идеальным для использования в производстве различных изделий.
Также металлическая связь играет важную роль в механизме проводимости электричества, поскольку электроны могут свободно двигаться по металлической структуре и создавать электрический ток. Это объясняет, почему металлы являются хорошими проводниками электрического тока и широко используются в электронике и электротехнике.
Таким образом, металлическая связь играет важную роль в определении свойств металлов и их поведения. Она обусловливает уникальные характеристики металлических материалов, которые делают их полезными и используемыми во многих отраслях промышленности и технологии.
Общие электронные пары

В химии понятие «общие электронные пары» описывает взаимодействие электронных оболочек атомов в молекуле или кристаллической решетке металла. Общие электронные пары играют важную роль в формировании связей между атомами и определяют физические и химические свойства металлов.
Когда атомы металла образуют кристаллическую решетку, их электронные оболочки перекрываются, что приводит к образованию общих электронных пар. Эти электроны мобильны и могут свободно перемещаться по решетке, обеспечивая проводимость металлической связи.
Общие электронные пары также обуславливают возможность металлов образовывать сплавы и легировать другие материалы. Атомы других элементов могут вступать во взаимодействие с общими электронными парами, что позволяет изменять структуру и свойства металлического материала.
Исследование общих электронных пар является важной задачей в современной теории металлической связи и помогает понять механизмы взаимодействия атомов в металлических материалах. Понимание этого явления позволяет улучшить производство и использование металлов в различных отраслях промышленности.
Донорные и акцепторные атомы
В металлической связи участвуют два типа атомов: донорные и акцепторные. Донорный атом отдаёт свои электроны, тогда как акцепторный атом принимает эти электроны.
В металлической структуре донорные атомы представлены металлическими катионами, которые отдают свои электроны в общий электронный облако. Эти электроны образуют плотное электронное облако, которое окружает катионы и обеспечивает их связывание.
Акцепторные атомы, с другой стороны, представлены атомами неметаллов или легких металлов, которые принимают электроны от донорных атомов. Это позволяет акцепторным атомам образовывать отрицательные ионы или области частичной отрицательной зарядки.
В результате взаимодействия донорных и акцепторных атомов образуется устойчивая структура металла с кристаллической решеткой. Каждый донорный атом имеет несколько акцепторных атомов вокруг себя, и эти акцепторные атомы влияют на свойства и строение металла.
Изучение роли донорных и акцепторных атомов в металлической связи позволяет лучше понять механизмы связывания атомов и свойства металлических материалов, что является важным для разработки и улучшения новых материалов с определенными характеристиками.
Положительные и отрицательные ионы
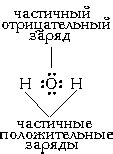
Ионы - это заряженные атомы или группы атомов, образованные путем потери или приобретения электронов. Получение или потеря электронов приводит к образованию положительных или отрицательных ионов соответственно.
Когда атом теряет один или несколько электронов, он превращается в положительный ион, называемый катионом. Положительный заряд катиона обусловлен большим количеством протонов по сравнению с электронами. Например, катион натрия Na⁺ образуется, когда атом натрия теряет один электрон.
В свою очередь, когда атом приобретает один или несколько электронов, он становится отрицательным ионом, который называется анионом. Отрицательный заряд аниона обусловлен наличием большего количества электронов по сравнению с протонами. Например, анион хлорида Cl⁻ образуется, когда атом хлора принимает один электрон.
Положительные и отрицательные ионы образуются в химических реакциях и важны для формирования различных соединений. Процесс образования ионов способствует стабилизации электрической зарядки атомов, а также образованию металлической связи и других видов химических связей.
Металлы и их способность к связыванию

Металлы являются особыми элементами, обладающими способностью к связыванию атомов в металлическую структуру. Их высокая концентрация свободных электронов и способность к образованию общих электронных пар являются основой для формирования сильных и устойчивых металлических связей.
Каждый атом металла обладает своими валентными электронами, которые могут перемещаться между атомами. Эти свободные электроны создают электронное облако, в котором атомы металла связаны друг с другом. Благодаря этому, металлы обладают высокой теплопроводностью и электропроводностью.
Основной принцип связывания атомов металла заключается в образовании общих электронных пар. При этом каждый атом металла вносит вклад в общую электронную оболочку, которая охватывает всех атомы в металлической структуре. Это обуславливает подвижность электронов и способность металлов обладать высокой пластичностью.
Металлическая связь также обеспечивает металлам высокую твердость и прочность. Общие электронные пары между атомами металла создают сильные электростатические взаимодействия, которые придают металлам их характерные механические свойства. Более того, металлы могут образовывать различные структуры, такие как решетка или кристаллическая решетка, в зависимости от способа связывания атомов.
Металлы как проводники электричества

Металлы обладают особыми свойствами, которые делают их хорошими проводниками электричества. Одним из ключевых свойств металлов является наличие свободных электронов. Внутри металлической решетки атомы расположены таким образом, что их внешние электронные оболочки могут свободно передвигаться.
Это означает, что в металлах существуют общие электронные пары, которые связывают атомы в решетке. Когда на металл подается электрический потенциал, свободные электроны начинают двигаться по металлической структуре, образуя электрический ток. Таким образом, металлы могут эффективно передавать электричество и служить в качестве проводников.
Уникальное свойство металлов - высокая подвижность свободных электронов. Это означает, что электроны могут свободно перемещаться внутри металлической решетки без существенного сопротивления со стороны атомов. Благодаря этому свойству, электронный ток может легко протекать через металл даже при небольших разностях потенциалов.
Кроме того, металлы обладают высокой теплопроводностью, что делает их полезными для конструкции электрических проводов. Это связано с подвижностью свободных электронов, которые могут передавать тепло от одной части металла к другой. Таким образом, металлы не только позволяют эффективно передавать электричество, но и быстро распространять тепло.
Значение металлической связи в промышленности

Металлическая связь имеет огромное значение в промышленности, так как обеспечивает структурную прочность и электропроводность металлических материалов, что позволяет использовать их во многих отраслях.
Во-первых, металлическая связь позволяет создавать прочные конструкции, которые выдерживают большие нагрузки. Это особенно важно в строительстве и авиационной промышленности, где требуется высокая прочность материалов. Благодаря общим электронным парам, которые образуют сверхпроводящие электроны, металлы обладают высокой твердостью и стойкостью к деформации.
Во-вторых, металлическая связь обеспечивает электропроводность материалов. Это делает металлы незаменимыми в электрических цепях и при создании электронной аппаратуры. Медь, алюминий и другие металлы широко используются в проводах и кабелях, а также при создании контактов и реле. Благодаря своей электропроводности, металлы также применяются в гальванических процессах и в производстве аккумуляторов.
Наконец, металлическая связь играет важную роль в процессах катализа. Металлы используются в катализаторах, которые ускоряют химические реакции и позволяют производить множество продуктов в промышленных масштабах. Например, платина, никель и другие металлы используются в катализаторах для производства синтетических полимеров, удобрений и ряда других химических веществ.
Вопрос-ответ

Что такое металлическая связь?
Металлическая связь - это тип химической связи, характерный для металлов, при котором между атомами металла образуется общая электронная оболочка.
Как образуется металлическая связь?
Металлическая связь образуется, когда валентные электроны в металле отделяются от своих атомов и образуют общую электронную оболочку, которая перемещается между положительными ядрами металлических атомов.
Какие электроны участвуют в металлической связи?
Участвуют валентные электроны, которые находятся на внешней оболочке атомов металла.
Чем отличается металлическая связь от ионной и ковалентной связей?
В отличие от ионной и ковалентной связи, в металлической связи электроны не связаны с конкретными атомами, а перемещаются по всей металлической решетке, образуя так называемое "море электронов".
Какие свойства металлов объясняются металлической связью?
Металлическая связь объясняет такие свойства металлов, как теплопроводность, электропроводность и пластичность.
