Взаимодействие кислотных окислителей с металлами является одной из фундаментальных реакций в химии. Этот процесс имеет множество особенностей и находит широкое применение в различных областях науки и техники. Кислотные окислители обладают способностью передавать электроны металлам, что приводит к изменению их окислительного состояния и химическим реакциям.
Важной особенностью взаимодействия кислотных окислителей с металлами является возможность образования оксидов металлов. Эти соединения являются прочными и стабильными, что делает их незаменимыми материалами для различных промышленных и технических целей. Например, оксиды металлов используются в производстве стекла, керамики, электроники, катализаторов и других важных материалов.
Кроме того, взаимодействие кислотных окислителей с металлами играет важную роль в электрохимии. Этот процесс используется при создании электролитических элементов, гальванических элементов и аккумуляторов. Кислотные окислители обеспечивают передачу электронов в химических реакциях, что позволяет осуществлять преобразование химической энергии в электрическую и наоборот.
Физико-химические свойства кислотных окислителей

Кислотные окислители обладают рядом уникальных физико-химических свойств, которые имеют важное значение во многих областях науки и технологии. Одной из основных характеристик кислотных окислителей является их способность принимать электроны от других веществ, что приводит к окислению последних. Это свойство позволяет использовать кислотные окислители в процессах синтеза органических соединений и промышленной химии.
Кислотные окислители также обладают высокой активностью и способностью взаимодействовать с различными металлами. Взаимодействие кислотных окислителей с металлами может происходить с образованием оксидов металлов, которые могут иметь важные функциональные свойства. Например, оксиды некоторых металлов могут быть использованы в качестве катализаторов или кондуктивных материалов.
Однако, следует отметить, что взаимодействие кислотных окислителей с металлами может иметь различную степень интенсивности в зависимости от свойств самих окислителей и металлов. Некоторые кислотные окислители могут обладать агрессивными свойствами и способностью разрушать металлические материалы. Поэтому важно учитывать все физико-химические параметры при проектировании и эксплуатации систем и устройств, в которых используются кислотные окислители.
Химическая реакция между кислотными окислителями и металлами
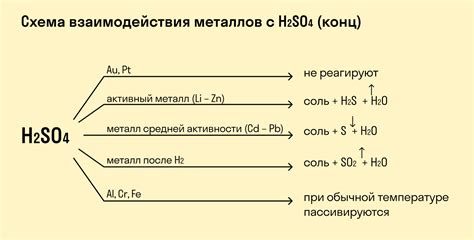
Кислотные окислители и металлы взаимодействуют друг с другом, образуя химическую реакцию. При этом происходит протекание окислительно-восстановительных процессов, что приводит к изменению химических свойств и состояний веществ.
Взаимодействие кислотных окислителей с металлами основано на том, что окислитель при этом пополняет свой электронный запас за счет отдаваемых металлом электронов. В результате образуется ион кислоты и ион металла, которые образуют новое вещество.
Примерами таких реакций могут служить реакция железа с соляной кислотой, в результате которой образуется ион железа (Fe2+) и ион хлорида (Cl-) в водном растворе. Эта реакция сопровождается выделением газа – водорода, и изменением цвета раствора.
Особенностью взаимодействия кислотных окислителей с металлами является эффект коррозии, при котором металл подвергается разрушению. При этом образуется оксид металла, который может быть нестабилен и дальше разрушаться в растворе. Коррозия способна привести к серьезным повреждениям металлических конструкций или изделий.
Понимание химических реакций между кислотными окислителями и металлами имеет важное практическое значение. Это позволяет разрабатывать новые материалы, улучшать технологии обработки металлов и предотвращать коррозию. Кроме того, такие реакции широко используются в химической промышленности, при производстве пищевых продуктов, фармацевтики и других отраслях.
Влияние свойств металлов на взаимодействие с кислотными окислителями

Металлы представляют собой важную группу элементов, которые демонстрируют различные свойства при взаимодействии с кислотными окислителями. Они могут проявлять себя как активные окислители, способные к электронному обмену, так и стать объектом окисления, реагируя с кислотными соединениями.
Одним из важнейших факторов, влияющих на процесс взаимодействия металлов с кислотными окислителями, является их электрохимический потенциал. Металлы с более низким потенциалом электродов обладают большей способностью вступать в реакцию с окислителями по сравнению с металлами с более высоким потенциалом. Это объясняется тем, что низкое значение электрохимического потенциала говорит о том, что металл имеет большую тенденцию отдавать электроны и окисляться.
Кроме того, важную роль играет химическая активность металлов. Некоторые металлы обладают большей способностью образовывать химические связи с кислотными окислителями, что способствует легкому протеканию окислительно-восстановительных реакций. Однако, у различных металлов могут быть разные окислительные свойства, которые влияют на тип и характер реакции с кислотным окислителем.
Также стоит отметить, что на взаимодействие металлов с кислотными окислителями может влиять внешний фактор, такой как концентрация кислотного окислителя. При высокой концентрации окислителя реакция будет происходить более интенсивно, в то время как при низкой концентрации может быть замедленная или не полностью завершенная реакция.
Основные виды кислотных окислителей

Кислоты являются одним из основных типов химических соединений, которые могут выступать в роли окислителей. Одним из наиболее распространенных видов кислот является серная кислота (H2SO4), которая широко используется в промышленности для производства удобрений, пластмасс и жидкостей для накаливания и аккумуляторов. Другим видом кислоты, используемой в качестве окислителя, является азотная кислота (HNO3), которая используется для производства взрывчатых веществ и удобрений. Оксиды азота, образующиеся при взаимодействии азотной кислоты с металлами, обладают мощными окислительными свойствами.
Пероксиды – это окислители, содержащие одну или несколько кислородных связей. Одним из наиболее известных пероксидов, который используется в качестве окислителя, является водородный пероксид (H2O2). Он широко применяется в медицине в качестве дезинфицирующего средства и отбеливателя. Водородный пероксид также используется в процессах окисления в промышленности и в бытовых условиях.
Хлорные соединения – это окислители, содержащие хлор. Одним из наиболее распространенных хлорных соединений, которые используются в качестве окислителей, является хлорное вещество (Cl2). Оно широко применяется в изготовлении пластмасс, белого горячего и белителей. Хлорные соединения также используются в процессах очистки воды, дезинфекции и консервирования пищевых продуктов.
Карбонаты – это окислители, содержащие карбонатную группу CO32-. Одним из наиболее известных карбонатов, используемых в качестве окислителей, является пероксокарбонатный ион (CO42-). Этот ион широко применяется в процессах окисления и отбеливания, а также в производстве бумажной и целлюлозной промышленности.
Марганцовые соединения – это окислители, содержащие марганец. Одним из наиболее распространенных марганцовых соединений, которые используются в качестве окислителей, является марганцовый диоксид (MnO2). Он широко применяется в процессах окисления, в производстве батареек и зажимов. Марганцовые соединения также используются в стекольной промышленности для окраски стекла в фиолетовый цвет.
Приложение кислотных окислителей в производстве

Кислотные окислители широко применяются в производственных процессах различных отраслей. Они играют важную роль в химической, электронной, пищевой, фармацевтической и других отраслях промышленности.
Одним из главных применений кислотных окислителей является процесс очистки поверхности металлов перед их последующей обработкой. Окислители, такие как серная кислота, фосфорная кислота и хлорные соединения, помогают удалить окисленные слои с поверхности металла, придают ей необходимую чистоту и повышают адгезию покрытий.
Кислотные окислители также используются в процессах гальванического покрытия. Они помогают создать защитные и декоративные покрытия на поверхности металла. К примеру, в процессе гальванического никелирования, сульфатный оксид никеля используется как кислотный окислитель для создания электролитического раствора, в котором происходит осаждение никелевого покрытия на поверхности металла.
В производстве электроники кислотные окислители применяются для удаления органических загрязнений с поверхности микроэлектронных элементов. Они помогают снять слой фото-резита, который используется в процессе нанесения проводящих и изоляционных покрытий на печатные платы.
Также стоит отметить применение кислотных окислителей в производстве химических реактивов и медицинских препаратов. Например, перекись водорода используется в качестве окислителя при получении многих органических соединений, а также в процессе дезинфекции и стерилизации медицинского оборудования.
В целом, кислотные окислители являются неотъемлемой частью множества производственных процессов. Их применение обеспечивает оптимизацию технологий, повышение качества продукции и безопасность производства.
Технические и экологические аспекты взаимодействия кислотных окислителей с металлами
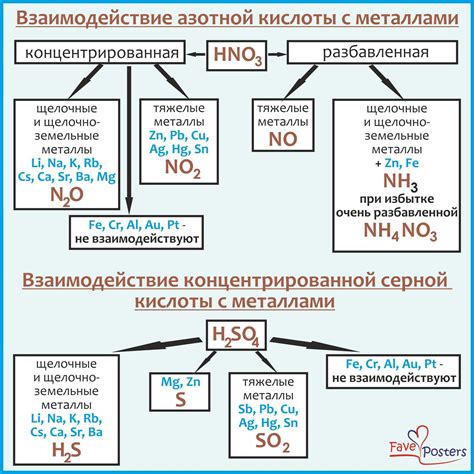
Взаимодействие кислотных окислителей с металлами имеет как технические, так и экологические аспекты. Технический аспект заключается в возможности использования этого взаимодействия для решения практических задач, таких как очистка поверхности металла от коррозии или создание защитных покрытий. Экологический аспект связан с влиянием этого процесса на окружающую среду и необходимостью его контроля.
Кислотные окислители, такие как серная кислота или хлорная кислота, способны взаимодействовать с металлами, вызывая коррозию. Этот процесс особенно активизируется в присутствии влаги и кислорода. Коррозия металлов может вызывать серьезные технические проблемы, например, разрушение конструкций или потерю работоспособности оборудования. Поэтому контроль и предотвращение коррозии являются важными задачами в инженерии и промышленности.
С другой стороны, взаимодействие кислотных окислителей с металлами может быть использовано в различных технологических процессах. Например, серная кислота может применяться для очистки поверхности металлов от окислов и загрязнений. Она способна растворять коррозию и удалять ее с поверхности, восстанавливая таким образом работоспособность металлических деталей.
Однако необходимо учитывать и экологические аспекты этого процесса. Использование кислотных окислителей может вызывать загрязнение окружающей среды. Отходы, образующиеся в результате взаимодействия, могут быть опасными и требуют правильной обработки и утилизации, чтобы минимизировать их негативное воздействие на окружающую среду.
Перспективы развития и исследования взаимодействия кислотных окислителей с металлами
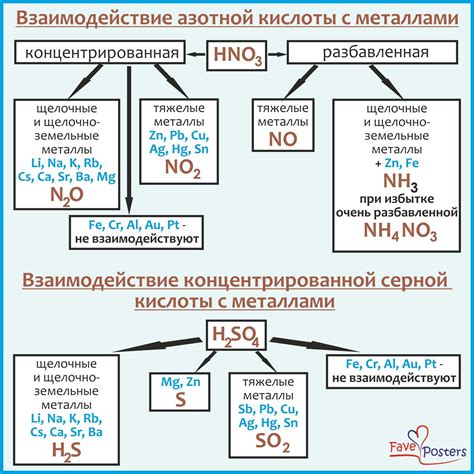
Взаимодействие кислотных окислителей с металлами представляет собой активное поле исследований, в котором с каждым годом появляются новые перспективные направления и открытия. Одной из главных целей исследований в этой области является повышение эффективности взаимодействия кислотных окислителей с металлами для создания более эффективных и экономически выгодных процессов и производств.
Одной из перспективных областей исследования является оптимизация процессов электрохимического окисления металлов, при котором кислотный окислитель реагирует с поверхностью металла под действием электрического тока. Исследования в этой области направлены на изучение электрохимических свойств различных кислотных окислителей и определение оптимальных условий реакции для повышения скорости и эффективности процесса.
Другим перспективным направлением исследований является взаимодействие металлов с кислотными окислителями при высоких температурах. Такие процессы использовались в металлургии для получения металлических сплавов и в процессах промышленного синтеза. Исследования в этой области позволяют определить оптимальные условия реакции и найти новые способы получения и обработки металлов.
Также активно исследуется взаимодействие кислотных окислителей с различными видами металлических поверхностей. Наноструктурированные материалы могут быть использованы для создания эффективных катализаторов или сенсоров. Исследования в этой области помогают определить оптимальные условия модификации поверхности металла с использованием кислотных окислителей.
Примеры успешного использования кислотных окислителей в различных отраслях промышленности

1. Металлургическая промышленность. В металлургии кислотные окислители широко используются для очистки и обезжиривания металлических поверхностей перед их дальнейшей обработкой. Например, с использованием соляной кислоты можно эффективно удалить окисленные слои и загрязнения с поверхности металла, что позволяет получить качественное изделие. Кислотные окислители также применяются для удаления никеля с поверхности металлов, что позволяет производить дальнейшую обработку без нежелательных эффектов.
2. Электронная промышленность. В электронной промышленности кислотные окислители находят применение в процессе производства электронных компонентов и печатных плат. Например, пероксид водорода используется для растворения металлов, таких как медь и никель, с целью удаления нежелательного оксидного слоя и обеспечения лучшей проводимости поверхности. Кроме того, кислотные окислители могут использоваться для улучшения адгезии металлических покрытий на поверхности печатных плат или для создания микроэлектронных структур.
3. Химическая промышленность. В химической промышленности кислотные окислители применяются в процессах окисления различных веществ. Например, с помощью кислотных окислителей, таких как перманганат калия или дихромат калия, можно производить окисление органических соединений с целью получения целевых продуктов. Кислотные окислители также широко используются в процессе синтеза сложных органических соединений, а также в процессе очистки и обеззараживания воды и сточных вод.
4. Пищевая промышленность. В пищевой промышленности кислотные окислители используются в различных процессах производства продуктов. Например, аскорбиновая кислота, также известная как витамин C, широко применяется как антиоксидант и консервант для увеличения срока годности и сохранения качества различных пищевых продуктов. Кроме того, кислотные окислители также могут использоваться для изменения pH-значения продуктов, для создания определенного вкуса или для регулирования процессов ферментации.
Вопрос-ответ

Какие металлы могут взаимодействовать с кислотными окислителями?
С кислотными окислителями могут взаимодействовать различные металлы, такие как железо, алюминий, медь, цинк и другие. Однако каждый металл проявляет свои особенности и реакции при контакте с кислотными окислителями.
Какие особенности взаимодействия металлов с кислотными окислителями?
Взаимодействие металлов с кислотными окислителями может происходить различными способами: окисление металла, образование растворов металлических солей, образование соединений с характерными свойствами и т.д. Каждый металл проявляет свои особенности и может иметь различную степень реакционности с кислотными окислителями.
В каких областях находят применение взаимодействия металлов с кислотными окислителями?
Взаимодействие металлов с кислотными окислителями находит применение в различных областях, таких как производство металлокомплексных соединений, электрохимические процессы, гальваническое покрытие, аккумуляторы, очистка и обработка металлов и др. Эти процессы широко используются в промышленности, научных исследованиях и повседневной жизни.
