Растворимость щелочных металлов в воде является важным свойством, определяющим их поведение и реактивность в различных химических процессах. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают характерными особенностями, отличающимися от других элементов периодической таблицы.
Первым заметным особенным свойством щелочных металлов является их высокая реактивность с водой. При контакте с водой происходит быстрая и интенсивная реакция, сопровождающаяся выделением водорода и образованием щелочных растворов. Растворимость щелочных металлов в воде обусловлена их способностью образовывать ионы, которые при соприкосновении с водой расщепляются на положительные ионы металла и отрицательные ионы гидроксида.
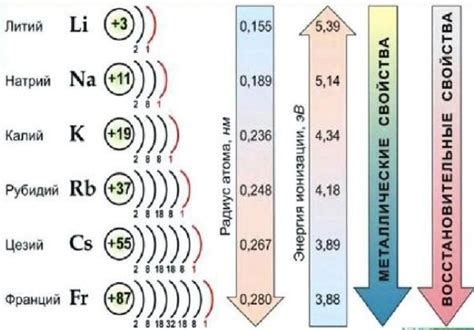
Однако растворимость щелочных металлов возрастает с увеличением размера атома и ионного радиуса. Например, литий, имеющий наименьший размер атома среди щелочных металлов, обладает наибольшей растворимостью, а калий, с наибольшим размером атома, обладает наименьшей растворимостью. Это объясняется тем, что большие ионы металла имеют меньшую положительную заряду на единицу объема, что облегчает их расщепление в растворе и повышает их растворимость.
Определение растворимости щелочных металлов
Растворимость щелочных металлов - это способность данных металлов растворяться в воде или других растворах. Она определяется концентрацией ионов металла в растворе и может быть выражена в граммах или молях вещества, растворенного в единицу объема раствора.
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают очень высокой растворимостью в воде. Например, натрий и калий могут полностью раствориться, образуя гидроксиды, которые являются сильными щелочами.
При определении растворимости щелочных металлов следует учитывать различные факторы, влияющие на процесс. Это может быть температура, давление, концентрация других растворенных веществ, растворимость основы и другие параметры.
Для некоторых щелочных металлов существует также зависимость растворимости от рН среды. Например, растворимость гидроксидов лития и натрия возрастает с повышением рН, в то время как растворимость гидроксидов калия, рубидия и цезия уменьшается при повышении рН.
Определение растворимости щелочных металлов является важным для понимания их химических свойств и использования в различных процессах и промышленных приложениях. Это также позволяет осуществлять контроль качества продуктов и разрабатывать эффективные методы извлечения и очистки щелочных металлов.
Факторы, влияющие на растворимость щелочных металлов

Растворимость щелочных металлов в воде является важным свойством, которое зависит от нескольких факторов. Одним из основных факторов, влияющих на растворимость щелочных металлов, является их размер и заряд. Чем меньше размер атома щелочного металла и чем больше его заряд, тем больше вероятность, что он будет растворяться в воде.
Также важную роль в растворимости играет химическая активность щелочных металлов. Более активные металлы, такие как литий и натрий, имеют большую способность реагировать с водой и образовывать гидроксиды, что способствует их растворению. Пассивные металлы, такие как калий и рубидий, обладают меньшей активностью и могут быть менее растворимыми.
Температура также оказывает влияние на растворимость щелочных металлов. Обычно, при повышении температуры, растворимость щелочных металлов увеличивается. Это связано с тем, что при повышенной температуре, молекулы воды обладают большей энергией и могут лучше разделить частицы металла, способствуя их распаду и растворению.
Кроме того, на растворимость щелочных металлов оказывает влияние их концентрация в растворе. Чем выше концентрация металла, тем больше вероятность его растворения. Однако, при достижении насыщенного раствора, растворимость может прекратиться и начаться процесс выпадения осадка.
Итак, факторы, влияющие на растворимость щелочных металлов, включают размер и заряд металла, его химическую активность, температуру и концентрацию в растворе. Понимание этих факторов помогает объяснить особенности и изменения растворимости щелочных металлов и может быть полезным при решении практических задач в химии и науке о материалах.
Почему растворимость щелочных металлов изменяется

Растворимость щелочных металлов зависит от нескольких факторов, включая температуру раствора, наличие других веществ и растворителей, а также свойства самих металлов. Одним из основных факторов, влияющих на растворимость щелочных металлов, является реакция с водой.
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, реагируют с водой, образуя щелочные гидроксиды. Реакция идет с выделением водорода и образованием гидроксидов. Растворимость гидроксидов щелочных металлов зависит от реактивности металла и его способности образовывать ионы в растворе.
Однако, не все щелочные металлы растворяются равномерно в воде. Например, литий и натрий растворяются хорошо, образуя сильные гидроксиды. В то же время, калий и цезий растворяются значительно хуже. Это связано с различием в энергии реакции и способности образовывать стабильные гидроксиды. Также растворимость щелочных металлов может изменяться в зависимости от концентрации растворов и наличия других веществ.
Кроме того, температура играет важную роль в изменении растворимости щелочных металлов. Обычно растворимость гидроксидов щелочных металлов увеличивается с повышением температуры. Это обусловлено термодинамическими факторами, связанными с изменением энтальпии и энтропии при растворении веществ.
В заключение, растворимость щелочных металлов является комплексным явлением, зависящим от множества факторов. Реакция с водой, тип растворителя, наличие других веществ и температура - все это влияет на растворимость щелочных металлов и определяет их поведение в растворах.
Вопрос-ответ

Почему растворимость щелочных металлов изменяется в разных средах?
Изменение растворимости щелочных металлов в разных средах обусловлено различной степенью взаимодействия между щелочными металлами и растворителем. Щелочные металлы, такие как натрий, калий и литий, имеют сильные ионообразующие свойства и хорошо растворяются в воде, образуя щелочные растворы. Однако, при взаимодействии с другими солями или кислотами, растворимость щелочных металлов может изменяться. Например, металлы с большой зарядностью, такие как калий и рубидий, имеют большую растворимость в соляной кислоте, чем в воде. Это связано с образованием более стабильного комплексного иона K+ или Rb+, которые легче растворяются.
Что определяет растворимость щелочных металлов в различных растворителях?
Растворимость щелочных металлов в различных растворителях определяется двумя основными факторами: энергией решетки и энергией гидратации. Энергия решетки - это энергия, необходимая для разрушения кристаллической решетки металла и образования ионов. Чем меньше энергия решетки, тем больше растворимость. Энергия гидратации - это энергия, выделяемая при образовании гидратированных ионов водой. Чем больше энергия гидратации, тем меньше растворимость. Например, цезий имеет меньшую растворимость, чем литий, потому что энергия гидратации иона Cs+ больше энергии гидратации иона Li+.
