Щелочные металлы - это группа элементов, состоящих из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Они относятся к первой группе периодической системы элементов и обладают рядом уникальных характеристик. Щелочные металлы являются самыми реактивными металлами из всех элементов, их реакции с водой и кислородом особенно известны.
Основные характеристики щелочных металлов включают в себя малую плотность, низкую температуру плавления и высокую реактивность. Металлы этой группы легко окисляются, освобождая большое количество энергии. У них также низкая температура воспламенения, что делает их очень горючими.
Важно отметить, что щелочные металлы не являются обычными металлами, которые мы видим в повседневной жизни. Их химические свойства делают их очень реактивными, что требует особой осторожности при обращении с ними.
Реакции щелочных металлов с водой особенно известны. При контакте с водой металлы этой группы образуют гидроксид и высвобождаются водород. Некоторые металлы могут даже воспламеняться при контакте с водой из-за высокой реактивности. Реакции щелочных металлов с кислородом также представляют большой интерес. Металлы тлеют при контакте с воздухом, образуя оксид, который защищает их поверхность от дальнейшего окисления.
Щелочные металлы: суть, свойства, таблица реакций
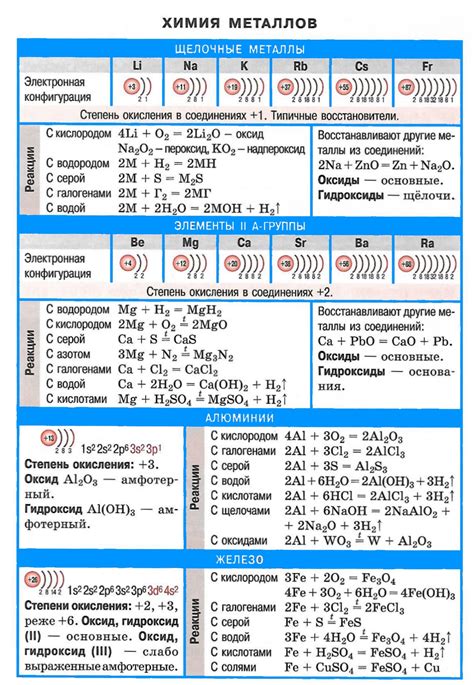
Щелочные металлы представляют собой группу элементов, которые относятся к первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой реактивностью, что связано с их электрохимическими свойствами.
Важной характеристикой щелочных металлов является их способность образовывать щелочные растворы, обладающие высоким pH. Это обусловлено тем, что щелочные металлы образуют гидроксиды, которые легко растворяются в воде и дают щелочные растворы. Эти растворы имеют важное применение, например, в процессе нейтрализации кислотных растворов.
Таблица реакций щелочных металлов позволяет увидеть их активность при взаимодействии с различными веществами. Основные характеристики реакций щелочных металлов включают образование гидроксидов при взаимодействии с водой, высвобождение водорода при взаимодействии с кислотами и образование солей при взаимодействии с кислотными оксидами.
| Металл | Реакция с водой | Реакция с кислотами | Реакция с оксидами |
|---|---|---|---|
| Литий (Li) | Образование гидроксида и высвобождение водорода | Высвобождение водорода | Образование соли |
| Натрий (Na) | Образование гидроксида и высвобождение водорода | Высвобождение водорода | Образование соли |
| Калий (K) | Образование гидроксида и высвобождение водорода | Высвобождение водорода | Образование соли |
Таблица реакций щелочных металлов является важным материалом для изучения их свойств и взаимодействия с другими веществами. Она помогает увидеть общие закономерности и отличия в реакциях щелочных металлов, что является основой для дальнейшего изучения этой группы элементов.
Реакции щелочных металлов с водой:

Щелочные металлы, такие как литий, натрий, калий и т. д., проявляют характерную реакцию с водой. При контакте с водой они быстро распадаются, выделяя водород и образуя щелочные растворы.
Реакция начинается с того, что щелочный металл вступает в контакт с водой и происходит ионизация: металл образует ионы металла, а вода расслаивается на ионы водорода (протоны) и ионы гидроксида. Результатом реакции является образование горячей щелочной смеси и выделение пузырьков водорода.
Пример реакции можно представить следующим образом:
- Литий + вода → литий гидроксид + водород
- 2Na + 2H₂O → 2NaOH + H₂↑
- K + H₂O → KOH + H₂↑
Такие реакции относятся к экзотермическим, то есть сопровождаются выделением большого количества тепла. Они являются базическими, так как образуется щелочь, а раствор оказывает щелочную реакцию.
Характер реакции щелочных металлов с водой зависит от их активности: чем выше активность, тем более интенсивная реакция происходит. Например, литий реагирует с водой очень быстро и жестко, в то время как реакция калия является более плавной и медленной.
Реакции щелочных металлов с кислородом:
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), реагируют с кислородом (O2) подобным образом, образуя оксиды.
В результате прямой реакции между щелочными металлами и кислородом, образуется оксид металла. Например, литий горит в кислороде, образуя оранжевые пламя и образуя оксид лития:
4Li + O2 → 2Li2O
Эта реакция происходит при нормальных условиях (температура и давление).
Реакция щелочных металлов с кислородом может также происходить путем образования перекиси. Например, натрий горит в кислороде, образуя пламя и перекись натрия:
6Na + O2 → 2Na2O2
Образование перекиси связано с высокой активностью щелочных металлов и их способностью образовывать соединения с большим количеством кислорода.
Реакции щелочных металлов с хлором:
Щелочные металлы, такие как литий, натрий, калий и др., проявляют активность при взаимодействии с хлором.
Щелочные металлы реагируют с хлором, образуя соответствующие хлориды. Например, литий реагирует с хлором, образуя хлорид лития (LiCl), а натрий образует хлорид натрия (NaCl).
Реакция щелочных металлов с хлором происходит с выделением большого количества энергии и сопровождается образованием белого дыма.
Взаимодействие щелочных металлов с хлором является экзотермическим процессом, то есть сопровождается выделением тепла. Это связано с высокой энергией образования хлорида щелочного металла.
Реакции щелочных металлов с хлором протекают очень быстро и сильно, поэтому требуется осторожность при их проведении. Контакт с реагентами должен происходить в специально оборудованных лабораториях или под наблюдением опытного специалиста.
Таблица: реакции щелочных металлов с различными веществами
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, обладают высокой химической активностью и способны быстро реагировать с различными веществами. Ниже представлена таблица, в которой перечислены основные реакции щелочных металлов с различными веществами:
| Вещество | Реакция |
|---|---|
| Вода (H2O) | Щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород (H2). |
| Кислород (O2) | Под действием кислорода щелочные металлы окисляются, образуя оксиды. |
| Хлор (Cl2) | Реакция щелочных металлов с хлором приводит к образованию хлоридов, сопровождающихся выделением тепла. |
| Сера (S) | Щелочные металлы реагируют с серой, образуя сульфиды. |
| Кислоты | Щелочные металлы реагируют с кислотами, образуя соли и выделяя воду. |
Такие реакции щелочных металлов с различными веществами обусловлены их высокой реакционной способностью и стремлением к достижению более стабильного химического состояния. Эти реакции имеют важное значение в различных химических процессах и позволяют использовать щелочные металлы в различных технологических процессах и промышленности.
Вопрос-ответ

Какие вещества могут вызывать реакции щелочных металлов?
Щелочные металлы обладают высокой реакционной способностью и могут реагировать с различными сильноэлектроотрицательными элементами, такими как галогены (хлор, бром, йод), кислород или сера.
Какие основные характеристики у реакций щелочных металлов?
Реакции щелочных металлов характеризуются высокой скоростью и интенсивностью. Они обычно сопровождаются выделением тепла и газов. Эти реакции происходят с образованием солей и высвобождением водорода.
Можно ли провести реакцию щелочных металлов с водой?
Да, щелочные металлы могут реагировать с водой. При взаимодействии с водой они диссоциируют, образуя щелочные гидроксиды и высвобождая водород. Это реакция очень интенсивная и сопровождается высвобождением большого количества тепла. Некоторые щелочные металлы, такие как калий или натрий, реагируют с водой даже с искрой и самовозгораются.
