Металлы являются незаменимыми элементами в нашей повседневной жизни. Они используются в различных областях, начиная от строительства и производства машин до производства украшений и электроники. Взаимодействие металлов с кислотами является одной из фундаментальных химических реакций, которая играет ключевую роль в различных процессах.
Кислоты могут реагировать с металлами различными способами. Одним из наиболее распространенных способов взаимодействия является образование солей и выделение водорода. Реакция между кислотами и металлами происходит следующим образом: металл отдает электроны, образуя катионный комплекс с кислотой, в то время как кислота получает электроны и образует анионный комплекс.
Однако, взаимодействие металлов с кислотами зависит от ряда факторов, таких как концентрация кислоты, температура, наличие растворителя и других химических субстанций. Некоторые металлы, такие как железо и цинк, реагируют с кислотами с выделением водорода, в то время как другие металлы, такие как алюминий и медь, могут образовывать оксиды или соль. Кроме того, некоторые металлы, такие как золото и платина, практически нереактивны с кислотами и поэтому широко используются в ювелирных и электронных изделиях.
Процессы взаимодействия металлов с кислотами

Взаимодействие металлов с кислотами происходит в результате химических реакций, которые могут протекать с разной интенсивностью и скоростью, в зависимости от свойств самих металлов и кислот.
Взаимодействие металлов с кислотами основано на ионном обмене: металл освобождает свои ионы в раствор кислоты и занимает место в растворе, взамен ионов водорода, которые переходят на поверхность металла.
Реакции взаимодействия металлов с кислотами могут протекать как с выделением газа, так и без него. При выделении газа наблюдается пузырьковое покачивание раствора. Такие реакции характерны, например, для цинка и соляной кислоты, алюминия и соляной кислоты, железа и серной кислоты.
Без выделения газа реакции взаимодействия металлов с кислотами проходят более тихо и незаметно. В результате этих реакций образуется соль металла и вода, например, при взаимодействии железа и уксусной кислоты, меди и серной кислоты, свинца и уксусной кислоты.
Типы реакций металлов с кислотами

Взаимодействие металлов с кислотами может приводить к различным типам реакций. Одни металлы не реагируют с кислотами, другие просто вступают в растворение, а третьи могут образовывать газы или соли.
1. Растворение металла в кислоте. Некоторые металлы, такие как железо, цинк или алюминий, могут растворяться в кислотах с образованием солей и выделением водорода. Например, реакция железа с соляной кислотой:
Fe + 2HCl → FeCl2 + H2
2. Выделение газа. Некоторые металлы, такие как цинк или алюминий, взаимодействуют с кислородом воды, образуя газ. Например, реакция алюминия с серной кислотой:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
3. Образование солей. Некоторые металлы реагируют с кислотами, образуя соли. Например, реакция меди с соляной кислотой:
2Cu + 4HCl → 2CuCl2 + 2H2
Таким образом, реакция металлов с кислотами может иметь различные характеристики и приводить к образованию разных продуктов реакции.
Влияние электрохимических свойств металлов на реакцию с кислотой

Электрохимические свойства металлов существенно влияют на их реакцию с кислотами. Эти свойства связаны с тем, что металлы обладают определенной электропроводностью и могут образовывать ионы в растворах. При взаимодействии с кислотой, металл может отдавать электроны, образуя положительно заряженные ионы, которые растворяются в воде или растворе кислоты.
Реакция металлов с кислотами может протекать различными способами в зависимости от их электрохимических свойств. Некоторые металлы, такие как алюминий и цинк, обладают большой активностью и реагируют с кислотами с выделением водорода и образованием соответствующих солей. Другие металлы, например, золото и платина, являются менее активными и не реагируют с кислотами.
Также важным фактором, влияющим на реакцию металлов с кислотами, является их упорядоченность в ряду электрохимической активности. Чем выше металл расположен в ряду активности, тем большую активность он обладает и тем более яркую и интенсивную реакцию с кислотой он проявляет. Наоборот, металлы, расположенные ниже в ряду активности, могут быть менее активными и проявлять менее интенсивные реакции.
Важно отметить, что реакция металлов с кислотами может сопровождаться выделением тепла или поглощением тепла, в зависимости от конкретного металла и кислоты. Например, реакция цинка с соляной кислотой сопровождается выделением тепла, в то время как реакция некоторых других металлов может протекать с поглощением тепла.
Особенности реакций различных групп металлов с кислотами

Реакция металлов с кислотами является химическим процессом, который приводит к образованию солей и выделению водорода. Однако, в зависимости от группы металлов, реакция может проходить с разными особенностями.
1. Щелочные металлы (литий, натрий, калий) и щелочноземельные металлы (магний, кальций, барий): Эти металлы образуют сильнощелочные растворы гидроксидов, поэтому их реакция с кислотами проходит очень активно. В результате образуются соль и выделяется большое количество водорода. Реакции данных металлов с кислотами сопровождаются высвобождением большого количества энергии.
2. Алюминий: Реакция алюминия с кислотами проходит с образованием солей алюминия и выделением водорода. Однако, алюминий обладает специфической особенностью - он способен образовывать плотный оксидный слой на своей поверхности, что делает его устойчивым к дальнейшему взаимодействию с кислотой.
3. Железо: Взаимодействие железа с кислотами зависит от его степени окисления. Железо в двухвалентной окислительной форме реагирует с образованием солей и выделением водорода. Однако, в трехвалентной форме железо становится устойчивым к реакции с кислотами.
4. Платина: Платина обладает высокой химической стойкостью и не реагирует с большинством кислот. Однако, сильные окислители, такие как концентрированная азотная кислота, могут привести к окислению платины.
Таким образом, реакции металлов с кислотами различаются в зависимости от их химических свойств и особенностей. Изучение этих реакций позволяет более глубоко понять взаимодействие металлов и кислот, а также их применение в различных областях химии и промышленности.
Примеры реакций металлов с кислотами
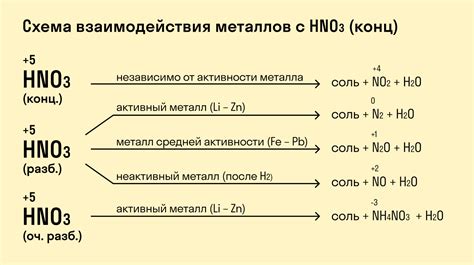
Реакция металлов с кислотами является химическим процессом, при котором происходит образование соли и выделение водорода. Некоторые металлы обладают большей реакционной способностью и реагируют с кислотами более интенсивно, например, щелочные металлы, такие как натрий и калий.
Примером реакции металлов с кислотами может служить реакция цинка с соляной кислотой. При взаимодействии этих веществ образуется хлорид цинка и выделяется водород:
Zn + 2HCl → ZnCl2 + H2
Еще одним примером реакции металла с кислотой является реакция магния с серной кислотой. В результате этой реакции образуются сульфат магния и выделяется водород:
Mg + H2SO4 → MgSO4 + H2
Взаимодействие алюминия с соляной кислотой также является примером реакции металла с кислотой. При этом образуется алюминий хлорид и выделяется водород:
2Al + 6HCl → 2AlCl3 + 3H2
Таким образом, реакция металлов с кислотами представляет собой важный процесс, который может быть использован в различных химических реакциях и препаративных процессах.
Значение взаимодействия металлов с кислотами в природе и промышленности

Взаимодействие металлов с кислотами является важным процессом как в природе, так и в промышленности.
В природе многочисленные геологические процессы, такие как эрозия, подземные воды и выветривание, способствуют высвобождению металлов в окружающую среду. Когда эти металлы взаимодействуют с кислотными соединениями воды, например, с дождевыми каплями, происходит процесс растворения металлов и их переноса в различные водные резервуары. Это взаимодействие может оказывать влияние на состав и качество водной экосистемы.
В промышленности взаимодействие металлов с кислотами используется для различных целей. Например, этот процесс может быть включен в химические реакции для производства различных продуктов. Металлы могут выступать в качестве катализаторов, ускоряющих реакцию разложения кислотных соединений или идущих в реакцию с кислотами для образования новых соединений.
Одним из важных примеров применения взаимодействия металлов с кислотами в промышленности является процесс гальванизации. В этом процессе металлические изделия погружаются в раствор кислоты, что приводит к их покрытию тонким слоем металла. Это позволяет защитить металл от коррозии и улучшить его внешний вид.
Таким образом, взаимодействие металлов с кислотами имеет значительное значение в природе и промышленности. Этот процесс может влиять на окружающую среду и использоваться для производства различных продуктов на основе металлов.
Практическое применение реакций металлов с кислотами

Реакции металлов с кислотами имеют широкое практическое применение в различных отраслях науки и промышленности. Одним из наиболее распространенных применений является использование данных реакций в химическом синтезе.
Металлы могут реагировать с различными кислотами, образуя соли металлов. Эти соли могут использоваться в качестве катализаторов во многих химических процессах. Например, соли платины или палладия используются в качестве катализаторов в процессе гидрогенирования органических соединений.
Кроме того, реакции металлов с кислотами являются основой для получения многих промышленных продуктов. Например, азотная кислота реагирует с аммиаком, образуя нитраты различных металлов, которые широко используются в производстве взрывчатых веществ.
Реакции металлов с кислотами также находят применение в аналитической химии. Они используются для определения содержания металлов в различных образцах. Например, реакция цинка с серной кислотой используется для определения содержания цинка в растворах и пробы воды.
Также стоит отметить применение реакций металлов с кислотами в электрохимических процессах. Например, реакция цинка с соляной кислотой является основой для работы гальванических элементов и аккумуляторов.
Вопрос-ответ

Как происходит взаимодействие металлов с кислотами?
Взаимодействие металлов с кислотами происходит посредством обменных реакций. Металл отдает электроны и образует положительно заряженные ионы, а кислота принимает электроны и образует отрицательно заряженные ионы.
Какие особенности есть при взаимодействии металлов с кислотами?
Одной из особенностей является то, что не все металлы могут реагировать с кислотами. Некоторые металлы, такие как золото и платина, не реагируют с кислотами. Кроме того, взаимодействие металлов с кислотами может приводить к выделению водорода и образованию солей.
