Оксиды металлов побочных подгрупп являются неотъемлемой частью химического мира и обладают различными свойствами в зависимости от степени окисления. При уменьшении степени окисления металла изменяются его химические и физические характеристики, что приводит к различным применениям данных оксидов в различных областях науки и промышленности.
Уменьшение степени окисления металлов побочных подгрупп находится в тесной связи с изменением электронной структуры атомов. Физические свойства оксидов, такие как температура плавления, твердость, электропроводность, магнитные свойства и другие, зависят от количества электронов в валентной оболочке атомов. Поэтому уменьшение степени окисления приводит к изменению этих свойств, что может быть использовано для создания материалов с определенными заданными характеристиками.
Кроме физических свойств, изменение степени окисления металлов побочных подгрупп также влияет на их химические свойства. Многие оксиды металлов побочных подгрупп являются катализаторами реакций, и изменение степени окисления может повлиять на их активность и селективность. Это связано с изменением электронной структуры атома, что влияет на его способность взаимодействовать с другими веществами. Поэтому уменьшение степени окисления может привести к повышению каталитической активности оксидов и расширению их области применения в химической промышленности и катализе.
Окислительные свойства оксидов металлов побочных подгрупп
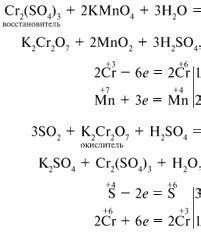
Оксиды металлов побочных подгрупп обладают различными свойствами, в том числе и окислительными. Окисление является процессом, при котором вещество теряет электроны, в то время как другое вещество, вступая в реакцию с ним, получает эти электроны. Оксиды металлов побочных подгрупп могут выступать в роли окислителя, то есть способствовать окислению других веществ.
Оксиды металлов побочных подгрупп с уменьшением степени окисления обладают более выраженными окислительными свойствами. Например, медь образует оксиды Cu+2O и Cu+1O, которые вступают в реакции окисления с другими веществами. Окислительные свойства оксидов металлов побочных подгрупп могут проявляться в присутствии соответствующих реагентов и при наличии подходящих условий, таких как температура и концентрация.
Окислительные свойства оксидов металлов побочных подгрупп можно использовать в различных технологических процессах. Например, оксид меди(II) (CuO) может использоваться для окисления органических веществ, таких как спирты. Эта реакция широко применяется в органической химии при синтезе различных соединений.
Окислительные свойства оксидов металлов побочных подгрупп могут также использоваться в процессах коррозии. Металлы побочных подгрупп, образуя оксидное покрытие на своей поверхности, могут служить защитой от дальнейшей коррозии. Например, окись цинка (ZnO) образуется на поверхности цинка и предотвращает дальнейшую окислительную реакцию металла с окружающей средой.
Физические свойства оксидов металлов побочных подгрупп

Оксиды металлов побочных подгрупп - это неорганические соединения, состоящие из металла и кислорода. Физические свойства оксидов металлов побочных подгрупп зависят от свойств и характеристик самих металлов и их ионов.
Температура плавления и кипения оксидов металлов побочных подгрупп может варьироваться в широких пределах. Например, оксид железа (III) обладает высокой температурой плавления (1535 °C), в то время как оксид цинка имеет низкую температуру плавления (1975 °C).
Твердость оксидов металлов побочных подгрупп также может различаться. Оксид цинка обладает высокой твердостью и является одним из самых твердых оксидов металлов, тогда как оксид алюминия является относительно мягким соединением.
Цвет оксидов металлов побочных подгрупп также может варьироваться. Например, оксид меди (II) имеет зеленый цвет, а оксид алюминия может быть белым, серым или красным в зависимости от структуры кристаллической решетки.
Растворимость оксидов металлов побочных подгрупп может также различаться. Некоторые оксиды, такие как оксид железа (III), практически не растворяются в воде, тогда как другие соединения, например оксид натрия, обладают высокой растворимостью.
Таким образом, физические свойства оксидов металлов побочных подгрупп являются результатом взаимодействия между свойствами металлов и кислорода, и они определяются структурой и химическим составом соединений.
Электрохимические свойства оксидов металлов побочных подгрупп

Оксиды металлов побочных подгрупп обладают различными электрохимическими свойствами, которые определяются их структурой и степенью окисления металла.
В зависимости от степени окисления металла в оксиде, его электрохимические свойства могут варьироваться. Например, оксиды металлов побочных подгрупп с низкой степенью окисления обычно проявляют кислотные свойства и могут растворяться в воде, образуя кислотные растворы. Это объясняется наличием кислородных атомов, которые могут образовывать протонные (водородные) катионы в воде.
С другой стороны, оксиды металлов побочных подгрупп с высокой степенью окисления, обычно проявляют щелочные свойства и растворяются в воде, образуя щелочные растворы. Это связано с наличием ионов гидроксила (OH-) в структуре оксида. Гидроксиды металлов побочных подгрупп широко используются в промышленности и научных исследованиях, например, в качестве базовых катализаторов или в процессах нейтрализации.
Оксиды металлов побочных подгрупп также обладают различными свойствами в реакциях окисления-восстановления. Они могут служить как окислителями, принимая электроны от другого вещества, или восстанавливаться, отдавая электроны. Такие реакции придают оксидам металлов побочных подгрупп важное значение как катализаторам в различных химических процессах.
Использование оксидов металлов побочных подгрупп в электрохимических процессах также широко распространено. Например, они используются в качестве электродов в гальванических элементах и акумуляторах. Электрохимические свойства оксидов металлов побочных подгрупп играют важную роль в процессах, связанных с передачей и хранением электрической энергии.
Каталитические свойства оксидов металлов побочных подгрупп

Оксиды металлов побочных подгрупп обладают значительными каталитическими свойствами, которые находят широкое применение в различных химических процессах. Каталитическая активность этих соединений обусловлена особыми структурными и электронными характеристиками, а также изменением степени окисления металла.
Одним из ключевых факторов, влияющих на каталитическую активность оксидов металлов побочных подгрупп, является изменение их степени окисления. При уменьшении степени окисления металла происходит изменение электронной структуры соединения, что способствует увеличению каталитической активности. Это связано с изменением энергетической структуры поверхности оксида и образованием активных центров, способных эффективно участвовать в химических реакциях.
Как правило, оксиды металлов побочных подгрупп с уменьшением степени окисления проявляют высокую активность в реакциях окисления, гидрогенирования, дегидрирования, полимеризации и других процессах. Они могут быть успешно применены в производстве различных химических веществ, включая катализаторы, красители, пластмассы, полимерные материалы и многое другое.
Более того, оксиды металлов побочных подгрупп могут обладать не только высокой каталитической активностью, но и специфичностью, что позволяет проводить реакции с высокой точностью и выбором. Это особенно важно в различных промышленных процессах, где требуется получение чистых продуктов с минимальным содержанием побочных продуктов и примесей.
В заключение, каталитические свойства оксидов металлов побочных подгрупп являются важным объектом исследования в области химии и промышленности. Их каталитическая активность и специфичность делают их незаменимыми материалами для проведения различных химических преобразований и получения ценных продуктов.
Термические свойства оксидов металлов побочных подгрупп
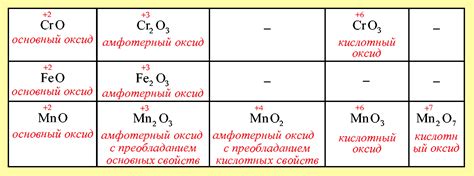
Оксиды металлов побочных подгрупп обладают различными термическими свойствами, которые определяются их структурой и степенью окисления металла. При нагревании оксиды металлов побочных подгрупп могут претерпевать различные изменения.
Некоторые оксиды металлов побочных подгрупп при нагревании могут выделять кислород и превращаться в металлы. Например, оксид меди(II) CuO при нагревании разлагается на медь и кислород. Этот процесс называется термическим разложением.
В отличие от них, некоторые оксиды металлов побочных подгрупп при нагревании могут превращаться в оксиды металлов более высокой степени окисления. Например, оксид свинца(II) PbO при нагревании превращается в оксид свинца(IV) PbO2. Этот процесс называется окислительной пиролизной реакцией.
Также некоторые оксиды металлов побочных подгрупп при нагревании могут сохранять свою структуру и степень окисления. Например, оксид железа(III) Fe2O3 при нагревании не меняет своей структуры и остается оксидом железа(III). Этот процесс называется стабильностью оксидов.
Таким образом, термические свойства оксидов металлов побочных подгрупп зависят от их структуры и степени окисления, и могут проявляться через термическое разложение, окислительную пиролизную реакцию или стабильность оксидов.
Вопрос-ответ

Почему свойства оксидов металлов побочных подгрупп изменяются с уменьшением степени окисления?
Оксиды металлов побочных подгрупп обладают различными степенями окисления, которые определяют их химические свойства. По мере уменьшения степени окисления, эти свойства могут изменяться, поскольку электронная структура металла и его окружающей среды меняется. Это может привести к изменениям в реакционной способности, кислотности и другим химическим свойствам оксида металла.
Какие свойства оксидов металлов побочных подгрупп изменяются с уменьшением степени окисления?
С уменьшением степени окисления оксидов металлов побочных подгрупп могут изменяться их окрашенность, растворимость, степень образования ионов металла и другие свойства. Например, оксиды металлов побочных подгрупп с более высокой степенью окисления могут быть более окрашенными, растворимыми и склонными к образованию ионов металла в растворах.
Каким образом уменьшение степени окисления влияет на химические свойства оксидов металлов побочных подгрупп?
При уменьшении степени окисления оксидов металлов побочных подгрупп меняется их реакционная способность. Например, оксиды с более низкой степенью окисления могут быть лучшими окислителями или агентами окисления, чем оксиды с более высокой степенью окисления. Они могут проявлять большую активность в химических реакциях, связанных с передачей электронов. Уменьшение степени окисления также может влиять на кислотность оксидов металлов побочных подгрупп и их способность вступать в реакции с другими веществами.
