Щелочные металлы, такие как литий, натрий, калий и др., обладают уникальными металлическими свойствами, такими как хорошая теплопроводность, электропроводность и пластичность. Однако эти свойства могут изменяться в зависимости от условий окружающей среды и химической реактивности.
Одна из причин изменения металлических свойств щелочных металлов - их реактивность с кислородом. При контакте с воздухом, щелочные металлы вступают в реакцию с кислородом, образуя оксиды. Это приводит к образованию пленки окислов на поверхности металла, что влияет на его химическую реактивность и электропроводность.
Еще одной причиной изменения свойств щелочных металлов является их способность растворяться в воде. Щелочные металлы реагируют с водой, образуя щелочь и высвобождая водород. Это происходит из-за образования гидроксидов щелочных металлов, которые изменяют свойства металла, а также влияют на его растворимость и реакционную способность.
Изменение металлических свойств щелочных металлов имеет важное практическое применение в различных отраслях науки и технологий. Например, изменение электропроводности и реакционной способности щелочных металлов позволяет их использовать в батареях, электротехнических устройствах и других электронных компонентах. Кроме того, растворимость и химическая активность щелочных металлов находят применение в производстве взрывчатых веществ, лекарственных средств и косметических продуктов.
Реакция щелочных металлов с кислородом
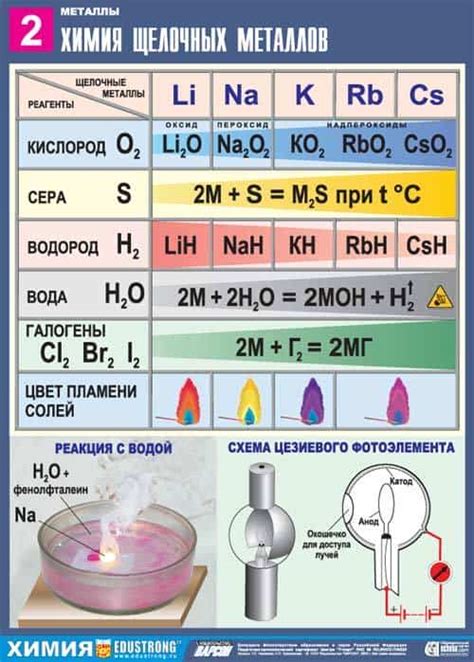
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, активно реагируют с кислородом. Эти реакции протекают с образованием оксидов щелочных металлов.
Взаимодействие щелочных металлов с кислородом происходит при повышенных температурах или после их нагревания. Оксиды щелочных металлов обладают высокой щелочностью и растворяются в воде, образуя гидроксиды.
Реакция щелочных металлов с кислородом является экзотермической и сопровождается выделением тепла и света. При сильном нагревании щелочные металлы сгорают в кислороде с ярким пламенем.
Оксиды щелочных металлов имеют важное практическое применение. Например, оксид натрия (Na2O) используется в производстве стекла, а оксид калия (K2O) — в производстве мыла и удобрений.
Взаимодействие щелочных металлов с водой

Вода - одно из наиболее распространенных и важных соединений на Земле. Она является средой, с которой щелочные металлы вступают в химическую реакцию.
Когда щелочный металл, такой как натрий или калий, погружается в воду, начинается интенсивное взаимодействие. Взаимодействие с водой приводит к образованию щелочной соли и выделению водорода.
Вода молекулярного водорода и кислорода H2O представляет собой нейтральное вещество, однако при взаимодействии с щелочными металлами она проявляет кислотные свойства.
Щелочные металлы обладают свойством активно взаимодействовать с водой, поскольку при этом происходит окисление металла, а в результате образуется щелочная соль. Водород, образующийся в процессе реакции, является горючим газом, поэтому при взаимодействии щелочных металлов с водой возникает яркий и шипящий эффект.
Это взаимодействие щелочных металлов с водой является одной из основных реакций, которая используется в различных рабочих процессах, таких как производство электроэнергии в горячих водных реакторах и производство водорода.
Таким образом, взаимодействие щелочных металлов с водой является важным процессом, который приводит к изменению металлических свойств щелочных металлов, создает новые соединения и находит применение в различных отраслях промышленности и научных исследованиях.
Образование щелочных металловых сплавов

Образование щелочных металловых сплавов является важным процессом, который находит свое применение в различных областях инженерии и науки. Сплавы, состоящие из щелочных металлов, обладают особыми свойствами, которые делают их полезными в различных приложениях.
Образование сплавов щелочных металлов происходит путем соединения щелочных металлов с другими элементами или сплавами. Это может быть смешивание щелочных металлов с другими металлами, такими как алюминий, магний или цинк. Или же можно соединить щелочные металлы с полимерными материалами, такими как полиэтилен или полипропилен.
Процесс образования сплавов щелочных металлов может быть достигнут разными способами. Одним из распространенных методов является плавление компонентов вместе при высоких температурах. В результате плавления и затвердевания образуется сплав, в котором щелочные металлы распределены равномерно по объему.
Сплавы щелочных металлов обладают уникальными свойствами, которые делают их полезными в различных областях. Например, некоторые сплавы могут быть очень легкими и прочными, что позволяет их использовать в авиационной и автомобильной промышленности. Другие сплавы могут быть проводниками электричества, благодаря чему они находят применение в электронике и электротехнике.
Образование сплавов щелочных металлов является важным процессом, который позволяет получить материалы с уникальными свойствами. Эти сплавы находят широкое применение в различных отраслях, от машиностроения и энергетики до медицины и электроники.
Использование щелочных металлов в батареях и аккумуляторах

Щелочные металлы, такие как литий, натрий и калий, нашли широкое применение в сфере энергетики благодаря своим особым свойствам. Они обладают высокой электрохимической реактивностью и способностью образовывать стабильные и энергетически эффективные соединения.
Батареи и аккумуляторы на основе щелочных металлов стали одним из основных источников энергии для различных устройств. Они используются в портативных электронных устройствах, таких как мобильные телефоны, ноутбуки, планшеты, а также в электрических автомобилях и энергетических сетях.
Одним из наиболее широко используемых типов аккумуляторов на основе щелочных металлов являются литий-ионные аккумуляторы. Они обладают высокой энергетической плотностью, длительным сроком службы и малым весом. Благодаря этим свойствам, они стали основным источником питания для мобильных устройств и электрических автомобилей.
Кроме лития, другие щелочные металлы, такие как натрий и калий, также используются в различных типах аккумуляторов. Натрий-ионные аккумуляторы, например, обладают большей стабильностью и меньшей стоимостью по сравнению с литиевыми аккумуляторами. Калий-ионные аккумуляторы, в свою очередь, обладают еще большей энергетической плотностью и могут быть использованы для энергоемких приложений, таких как электрические грузовики и накопители энергии для энергетической сети.
Роль щелочных металлов в синтезе органических соединений

Щелочные металлы играют важную роль в синтезе органических соединений благодаря своим уникальным химическим свойствам. Они активно применяются в различных химических реакциях и процессах для образования новых органических соединений.
Одним из главных преимуществ щелочных металлов в органическом синтезе является их высокая реакционная активность. Вода и воздух являются преградой для многих химических реакций, но щелочные металлы способны вступать в реакцию с водой и освобождать водород, что может быть полезно в определенных синтезах.
Щелочные металлы также широко используются в реакциях обмена и гидролиза, которые позволяют получать сложные органические соединения. Например, гидролиз щелочной металлической соли может привести к образованию кислоты или спирта, открывая новые возможности для синтеза органических соединений.
Более того, щелочные металлы способны образовывать стабильные комплексы с различными органическими соединениями. Это особенно важно в катализе, где комплексы щелочных металлов могут активировать реагенты и ускорять процесс образования желаемого соединения.
Кроме того, щелочные металлы часто используются в синтезе органических соединений для образования ионообменных смол, которые могут быть полезны в процессе очистки и разделения органических соединений.
Таким образом, роль щелочных металлов в синтезе органических соединений весьма значительна. Их химические свойства позволяют использовать их в различных реакциях и процессах, открывая новые возможности для синтеза сложных органических соединений.
Вопрос-ответ

Какие причины могут привести к изменению металлических свойств щелочных металлов?
Изменение металлических свойств щелочных металлов может быть вызвано различными причинами, включая изменение условий окружающей среды, введение примесей или легирование, а также изменение равновесных состояний в металлической решетке.
Как происходят процессы изменения металлических свойств щелочных металлов?
Процессы изменения металлических свойств щелочных металлов могут происходить через активацию диффузии, рекристаллизацию, формирование дислокаций или твердорастворные реакции. Эти процессы могут приводить к изменению электропроводности, твердости, пластичности и других свойств.
В каких областях применяются щелочные металлы с измененными свойствами?
Щелочные металлы с измененными свойствами находят применение в различных областях, таких как электроника, энергетика, катализ и химическая промышленность. Например, модифицированный литий может использоваться в аккумуляторах, а натрий с измененными свойствами может быть востребован в производстве стекла или алюминия.
