Щелочные металлы представляют собой группу химических элементов, которые находятся в первой группе периодической таблицы. К этой группе относятся такие элементы, как литий, натрий, калий, рубидий и цезий. В данной статье мы рассмотрим, как изменяются физические свойства этих металлов.
Литий – самый легкий из всех щелочных металлов. Он имеет низкую плотность и очень мягкий, легко режется ножом. При комнатной температуре литий имеет серебристо-белый цвет, однако при повышении температуры может переходить в розовый или красный оттенок. Помимо этого, литий обладает низкой температурой плавления и кипения, что делает его хорошим материалом для аккумуляторов.
Натрий – более распространенный металл. Он также обладает серебристо-белым цветом, но более ярким, чем литий. Натрий имеет высокую плотность и очень низкую температуру плавления. Он также достаточно мягкий, но менее мягкий, чем литий. Натрий широко используется в пищевой промышленности, а также для производства соды и щелочей.
Калий – элемент, используемый в физиологии человека. Он является необходимым микроэлементом и играет важную роль в работе клеток и мышц. Калий также имеет серебристо-белый цвет и высокую плотность. Одним из его особенностей является низкая температура плавления. Калий широко используется в сельском хозяйстве и промышленности, а также в продуктах питания.
Рубидий – металл, имеющий темно-фиолетовый цвет. Он имеет безопасные физиологические свойства и может быть использован в медицинских целях. Рубидий также обладает высокой плотностью и низкой температурой плавления. Он широко используется в оптике, лазерной технике и атомной физике.
Цезий – самый плотный металл среди всех щелочных металлов. Он имеет серебристо-белый цвет и высокую температуру плавления. Цезий также имеет широкие применения в научных исследованиях, включая область атомных часов и физики частиц.
Изменение физических свойств щелочных металлов
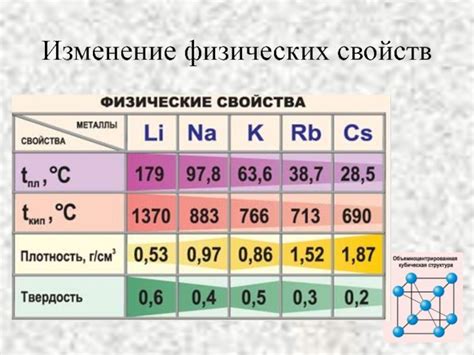
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), известны своими уникальными химическими и физическими свойствами. В основном, эти металлы хорошо проводят тепло и электричество, имеют низкую плотность и низкие температуры плавления.
Однако, с ростом атомного номера в периодической таблице, физические свойства щелочных металлов изменяются. Например, литий имеет самую низкую плотность и самую низкую температуру плавления среди всех щелочных металлов. Его плотность составляет около 0,53 г/см³, а температура плавления – 180,5 °C.
Натрий, в свою очередь, обладает немного большей плотностью – около 0,97 г/см³ и температурой плавления 97,8 °C. Калий имеет плотность порядка 0,86 г/см³ и температуру плавления 63,7 °C.
С ростом атомных номеров, как у рубидия, так и у цезия, плотность и температура плавления значительно возрастают. Рубидий имеет плотность около 1,53 г/см³ и температуру плавления 38,9 °C, в то время как цезий – самый тяжелый из всех щелочных металлов – обладает плотностью около 1,93 г/см³ и температурой плавления 28,4 °C.
Таким образом, физические свойства щелочных металлов изменяются с ростом атомного номера, приводя к изменению плотности и температуры плавления. Эти физические свойства определяют их использование в различных областях, включая электрохимию, фармацевтику, производство стекла и металлургию.
Литий - легкий металл с уникальными свойствами

Литий является самым легким из щелочных металлов и обладает рядом уникальных физических свойств.
Одной из его основных особенностей является его низкая плотность, благодаря которой он является самым легким металлом в периодической системе элементов. Плотность лития составляет всего около 0,53 г/см³, что делает его легким для обработки и транспортировки.
Ещё одним интересным свойством лития является его низкое плавление. Температура плавления лития составляет всего около 180 градусов Цельсия, что делает его одним из самых низкоплавких металлов. Благодаря этому свойству литий широко используется в производстве аккумуляторов, электродов и других электронных устройств.
Ещё одним уникальным свойством лития является его электропроводность. Литий является одним из самых лучших проводников электричества среди всех металлов. Его высокая электропроводность делает его незаменимым для производства аккумуляторов, а также используется в авиационной и космической промышленности.
Натрий - металлический элемент с активной реактивностью
Натрий - это химический элемент из группы щелочных металлов, имеющий атомный номер 11. Он обладает ярко-желтым металлическим блеском и является очень реактивным элементом.
Одной из характерных особенностей натрия является его активная реакция с водой. При контакте с водой натрий проявляет высокую активность, выделяясь в виде яркого пламени и образуя гидроксид натрия. В результате реакции с водой образуется щелочное растворимое вещество, которое имеет важное применение в различных отраслях промышленности и научных исследованиях.
Натрий также является химическим элементом, который широко используется в пищевой промышленности. Многие пищевые продукты содержат натрий в виде поваренной соли (хлорида натрия), которую мы используем для приготовления пищи и приправления различных блюд.
В природе наиболее распространенным минералом с натрием является роксалит – месторождение натрия, которое широко используется в процессе добычи и производства этого металла.
Калий - мягкий металл с высокой химической активностью

Калий - элеменt группы щёлочных металлов, который характеризуется высокой химической активностью. Он обладает серебристо-белым металлическим блеском и мягкостью. Калий является одним из самых реактивных металлов, он быстро окисляется на воздухе и реагирует с водой, выделяя сильно двигающийся водород.
Одной из особенностей калия является его способность к диффузии через многие мембраны. Из-за этого свойства он широко используется в клеточной физиологии и медицине.
Калий имеет низкую плотность, что делает его строительным материалом для легкой аэрокосмической промышленности. Калий также используется в производстве удобрений, при производстве стекла и мыла, а также в процессе очистки металлов и цветных металлов.
Калий широко распространен в природе и встречается в различных минералах, таких как сильвинит, карналлит и соли калия. Его наиболее крупное применение находится в сельском хозяйстве, где он является одним из важнейших элементов питания растений.
Вывод: Калий - это мягкий металл с высокой химической активностью и явлется неотъемлемой частью нашего повседневного жизни.
Рубидий - редкий металл с расширенным диапазоном применения

Рубидий является химическим элементом, принадлежащим к группе щелочных металлов на периодической таблице. Однако в отличие от своих соседей – лития, натрия и калия – рубидий представлен на Земле в значительно меньшем количестве и характеризуется редкостью. Он может быть выделен из минералов, таких как лепидолит или полевой шпат, но его концентрация в натуральных источниках остается невысокой.
Рубидий обладает уникальными физическими свойствами, которые находят свое применение в различных областях науки и промышленности. Например, благодаря своей химической реактивности, рубидий используется в процессе выделения ионов в веществах для рамановской спектроскопии. Кроме того, благодаря способности рубидия взаимодействовать с оптическим излучением, этот металл применяется в процессе создания оптических фильтров и объективов для видеокамер и других оптических устройств.
Рубидий также способен быть использованным в качестве источника электрической энергии. Вакуумные ионные двигатели, работающие на основе рубидия, могут предоставлять энергию для космических аппаратов и спутников. Более того, рубидий имеет высокую теплопроводность и может быть использован в качестве теплоносителя в некоторых технических устройствах, таких как термоэлектрические генераторы.
Таким образом, рубидий является не только редким металлом, но и материалом с уникальными свойствами, и его применение охватывает самые разные области науки и технологий, от оптики до космической инженерии.
Цезий - тяжелый металл с редкими применениями

Цезий является одним из щелочных металлов и расположен в пятидесятом ряду периодической таблицы Менделеева. Он обладает массовым числом 133 и атомным номером 55.
В природе цезий представлен в виде трех изотопов: один стабильный и два радиоактивных. Основной изотоп, цезий-133, имеет массово-числовое отношение 132.90539. Цезий является достаточно редким элементом и встречается главным образом в минералах, таких как лепидолит и бивит. Его наиболее крупные запасы обнаружены в Западной Австралии и южных регионах Китая.
Цезий имеет ряд химических и физических свойств, которые делают его применимым только в узком спектре областей. Например, цезий обладает высокой степенью реактивности и активностью, что делает его опасным взаимодействующим веществом. Кроме того, цезий имеет низкую точку плавления и кипения, что позволяет использовать его в жидком состоянии при некоторых процессах.
Одним из самых известных применений цезия является его использование в атомных часах. Изотоп цезия-133 используется в точных атомных часах для определения единицы времени - секунды. Также цезий используется в специализированной аппаратуре и контрольно-измерительных системах.
В медицине цезий применяется в некоторых радиотерапевтических процедурах, особенно при лечении рака. Однако такие применения цезия ограничены из-за его высокой радиоактивности и опасности для здоровья.
Следует отметить, что свойства цезия придают ему большой потенциал в различных областях науки и технологии. Однако из-за его ограниченных применений и сложности в обращении, практическое использование цезия остается довольно ограниченным.
Вопрос-ответ

Какие физические свойства могут изменяться у щелочных металлов?
У щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, могут изменяться такие физические свойства, как плотность, температура плавления и кипения, теплоемкость, теплопроводность, электропроводность, а также состояние агрегации (твердое, жидкое или газообразное).
Как меняется плотность щелочных металлов при изменении условий?
Становится ниже.
