Периодическая таблица химических элементов является важным инструментом для изучения химических свойств веществ. Щелочные металлы представлены в первой группе таблицы и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов есть массовое число, атомная масса и атомный номер. Одним из основных химических свойств щелочных металлов является их активность, которая изменяется при движении вниз по таблице.
Активность щелочных металлов определяется их способностью образовывать ионные связи с другими элементами. Благодаря наличию одного электрона в внешней энергетической оболочке, щелочные металлы легко отдают этот электрон, образуя положительные ионы. Литий наиболее активен среди щелочных металлов и может даже реагировать с водой, образуя водород. Натрий и калий также обладают высокой активностью и реагируют с водой, при этом выделяется водород. Однако, с увеличением атомного номера и массового числа, активность щелочных металлов снижается.
Рубидий и цезий являются менее активными, по сравнению с литием, натрием и калием. Они могут реагировать с водой при нагревании, но образуют менее интенсивную реакцию. Франций, самый тяжелый щелочный металл, является наименее активным элементом в этой группе. Он столь реакционноспособен, что его трудно получить в чистом виде и его свойства мало изучены.
Изменение активности щелочных металлов при движении вниз по периодической таблице обусловлено увеличением радиуса атомов и их электронной структуры. С увеличением размеров, атомы щелочных металлов становятся менее плотными, а связи между атомами становятся слабее. Это приводит к снижению активности их химических реакций, включая реакцию с водой. Таким образом, лишь первые три щелочных металла - литий, натрий и калий, обладают высокой активностью, а более тяжелые элементы этой группы проявляют меньшую реакционность.
В итоге, изменение активности щелочных металлов при движении вниз по периодической таблице объясняется электронными и структурными свойствами этих элементов. Это знание позволяет предсказывать химические свойства щелочных металлов и использовать их в различных областях науки и технологии.
Значение активности щелочных металлов при переходе на нижние уровни таблицы Менделеева

Активность щелочных металлов – это их способность вступать в реакции с веществами, основанная на свойствах их внешней электронной оболочки. При движении вниз по периодической таблице Менделеева, активность щелочных металлов обычно увеличивается.
Внешний слой электронной оболочки у щелочных металлов состоит из одного электрона, что делает их склонными к потере этого электрона и образованию ионов с положительным зарядом. При переходе на нижние уровни таблицы, атомы щелочных металлов становятся более крупными, и размер внешней оболочки становится больше.
Более крупные атомы на нижних уровнях таблицы Менделеева имеют более далекое расположение электронов от ядра, что снижает притяжение электронов к ядру. Это делает потерю внешнего электрона, необходимого для образования положительных ионов, более легкой. Таким образом, активность щелочных металлов возрастает при движении вниз по таблице.
Отметим, что активность щелочных металлов все же зависит не только от размера атома, но и от других факторов, таких как электронная конфигурация, силы кулоновского притяжения между электронами и ядром, а также наличие других оболочек электронов. Но в целом можно сказать, что при движении вниз по периодической таблице Менделеева активность щелочных металлов увеличивается.
Изначальное значение активности щелочных металлов

Щелочные металлы – первая группа элементов периодической таблицы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой активностью, что обусловлено их электронной структурой.
В электронных оболочках щелочных металлов наружным слоем находится всего один электрон. Причем, этот электрон находится очень далеко от ядра, что делает его легкоотделимым. Поскольку наружный электрон слабо притягивается ядром, щелочные металлы обладают высокой реакционной способностью.
Изначальное значение активности щелочных металлов определяется их положением в периодической таблице. Оно уменьшается с увеличением атомного номера элемента. Наиболее активным щелочным металлом является франций (Fr), а наименее активным – литий (Li). Это связано с тем, что у франция наружный электрон находится на большей расстоянии от ядра, а у лития – на меньшем расстоянии.
Изменение активности щелочных металлов при движении вниз по периодической таблице объясняется увеличением количества внутренних оболочек электронов. При этом, наружный электрон остается на том же расстоянии от ядра, однако, он стал периферическим внутри атома, поскольку наружные слои оказывают на него экранирующее воздействие. В результате, электронным оболочкам, находящимся ближе к ядру, легче участвовать в реакциях, чем наружному электрону.
Влияние электронной конфигурации на активность щелочных металлов

Щелочные металлы являются элементами первой группы периодической таблицы и обладают высокой активностью. Однако их активность может изменяться при движении вниз по таблице, что объясняется особенностями их электронной конфигурации.
Электронная конфигурация щелочных металлов характеризуется наличием одного внешнего электрона, находящегося на свободной, s-подуровней. В первой группе находятся элементы с одним, второй - с двумя, третьей - с тремя валентными электронами. В связи с этим активность щелочных металлов возрастает с увеличением числа валентных электронов.
Электронный конфигурационный фактор приводит к возрастанию либо уменьшению активности щелочных металлов при движении по периодической таблице. Например, литий (Li) с одним валентным электроном проводит его слабо, что делает его менее активным по сравнению с другими щелочными металлами, имеющими два или три валентных электрона.
- Натрий (Na) имеет два валентных электрона, что делает его более активным, чем литий.
- Калий (K) уже обладает тремя валентными электронами, что придает ему еще большую активность по сравнению с натрием и литием.
- Рубидий (Rb) имеет четыре валентных электрона, а цезий (Cs) - пять, что делает их самыми активными щелочными металлами.
Таким образом, электронная конфигурация оказывает существенное влияние на активность щелочных металлов. Чем больше валентных электронов на внешнем уровне, тем выше их активность. Это объясняется готовностью этих элементов отдавать электроны и образовывать ионы положительного заряда.
Появление новых химических свойств

При движении щелочных металлов вниз по периодической таблице возникают новые химические свойства, которые объясняются изменением их электронной структуры.
Одним из таких свойств является увеличение активности щелочных металлов. Чем ниже элемент располагается в периодической таблице, тем активнее он становится. Это обусловлено увеличением радиуса атома и уменьшением энергии ионизации при движении вниз по группе. Увеличение радиуса атома позволяет электронам легче отдаляться от ядра, что делает элемент более активным.
Другим новым свойством щелочных металлов при движении вниз по периодической таблице является их большая реакционная способность. Это проявляется в том, что они реагируют с веществами, с которыми их предшественники не взаимодействуют или взаимодействуют значительно медленнее. Это связано с возрастанием числа электронов во внешнем энергетическом уровне, что способствует возникновению новых комбинаций с другими элементами.
Кроме того, новыми химическими свойствами щелочных металлов при движении вниз по периодической таблице являются их большая реакционная способность с водой и максимальная способность образования положительных ионов. Помимо этого, по мере движения вниз по группе, щелочные металлы все больше проявляют металлические свойства, такие как хорошая проводимость электричества и тепла.
Увеличение размеров и массы атомов
При переходе щелочных металлов от верхних к нижним элементам периодической таблицы происходит увеличение размеров и массы атомов. Этот процесс обусловлен особенностями строения атомов щелочных металлов.
Атомы щелочных металлов имеют одну электронную оболочку, содержащую всего один электрон. При движении от верхних представителей группы (например, лития и натрия) к нижним (как калий, рубидий и цезий) происходит увеличение числа электронов на этой оболочке, следовательно, атомы приобретают большую массу и размеры.
Увеличение размеров атомов также связано с их электронной структурой. Периодическая таблица показывает, что с ростом атомного номера увеличивается энергия атома, а значит и его размеры. Как известно, чем больше атомная энергия, тем дальше находится электрон от ядра, и это приводит к увеличению размеров атома.
Увеличение массы атомов также объясняется электорнной структурой. Атомы натрия и других верхних представителей имеют меньшую массу, так как их ядра содержат меньше нейтронов. В результате перехода от лития к цезию, которые обладают все большим числом нейтронов в ядре, масса атомов увеличивается.
Таким образом, движение щелочных металлов вниз по периодической таблице приводит к увеличению размеров и массы атомов, что сказывается на их физических свойствах и реакционной способности.
Возрастание реакционной способности группы щелочных металлов

Группа щелочных металлов в периодической таблице состоит из элементов: лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Они являются самыми активными металлами и характеризуются высокой реакционной способностью.
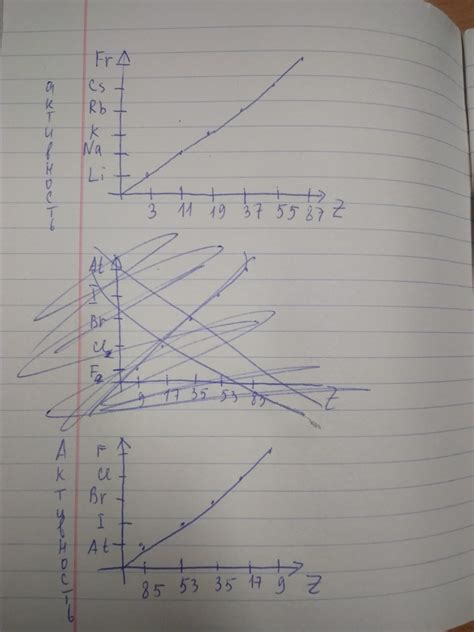
Важной особенностью группы щелочных металлов является возрастание реакционной способности при движении вниз по периодической таблице. Это связано с увеличением размера атомов и уменьшением энергии ионизации.
Литий, находящийся в верхней части группы, обладает наименьшей реакционной способностью среди щелочных металлов. Он способен реагировать только с некоторыми веществами и образовывать более слабые соединения.
На следующем месте находится натрий, который уже более активен и может реагировать со многими веществами, включая воду и кислород. Калий проявляет еще большую реакционную способность и способен гореть на воздухе.
Следующие элементы - рубидий, цезий и франций - являются самыми реакционноспособными в группе щелочных металлов. Они реагируют очень активно с водой, кислородом и другими веществами, часто сопровождаясь высвобождением значительного количества тепла.
Весьма наглядно возрастание реакционной способности щелочных металлов можно представить в виде таблицы:
| Металл | Реакция с водой | Реакция с кислородом |
|---|---|---|
| Литий | Медленно | Происходит |
| Натрий | Быстро, со шлейфом искр | Сильно, погорячее |
| Калий | Очень быстро, с огнем | Сложно зажечь, горит ярко |
| Рубидий | Мгновенно, с пламенем | Очень легко, с ярким пламенем |
| Цезий | Энергично, с пламенем | Очень легко, с ярким пламенем |
| Франций | Очень энергично, с пламенем | Очень легко, с ярким пламенем |
Таким образом, реакционная способность группы щелочных металлов возрастает с увеличением их атомного радиуса и уменьшением энергии ионизации.
Кроме этого, значения энергии ионизации щелочных металлов также увеличиваются при движении вниз по группе. Это связано с увеличением протонного числа в атомах и, как следствие, более сильным притяжением электронов.
Активность щелочных металлов в воде и во внешней среде
Щелочные металлы — это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой активностью в химических реакциях. Активность щелочных металлов в воде и во внешней среде определяется их положением в периодической таблице: она увеличивается при движении вниз по группе.
Вода является наиболее распространенной средой, в которой проявляется активность щелочных металлов. Щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. При этом активность металлов увеличивается от лития до цезия. Литий очень реактивен и быстро реагирует с водой, образуя литиевую щелочь и выделяя водород. Франций, в свою очередь, является наиболее активным щелочным металлом и обладает способностью самовозгораться в контакте с воздухом.
Однако активность щелочных металлов проявляется не только во взаимодействии с водой. Они также реагируют с другими веществами и элементами, такими как кислород, сера и галогены. В реакциях с кислородом и серой, щелочные металлы образуют оксиды и сульфиды. С галогенами они образуют галогениды металлов. При этом активность металлов проявляется в возможности замещения одного металла другим в соединениях.
Уровень активности группы щелочных металлов в соединениях

У щелочных металлов первой группы периодической таблицы, таких как литий, натрий, калий, рубидий и цезий, наблюдается высокий уровень активности в соединениях. Это связано с тем, что в этих элементах последняя электронная оболочка состоит из одного электрона.
Одним из проявлений высокой активности щелочных металлов является их способность образовывать гидроксиды, простые и сложные соли с кислотами и оксидами. Например, реакцией щелочных металлов с водой образуется гидроксид щелочного металла и выделяется водород. Это реакция сильного окислителя – щелочного металла с неметаллом, водород.
Щелочные металлы действуют также на многие неметаллы. Реакция между щелочным металлом и галогеном приводит к образованию соли галогена и галогидов щелочных металлов. Например, реакция натрия с хлором приводит к образованию хлорида натрия.
Важной особенностью активности щелочных металлов является то, что они легко окисляются, т.е. отдают электроны другим веществам. Это происходит из-за того, что уровень энергии связи между электроном и ядром у них низок. Благодаря этому свойству щелочные металлы используются в таких областях, как производство сплавов, пиротехника и батарейки.
Значение активности группы щелочных металлов в промышленности и научных исследованиях

Активность группы щелочных металлов в промышленности и научных исследованиях имеет значительное значение и вызывает большой интерес у ученых и инженеров. Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой реактивностью из-за низкой энергии ионизации и готовности отдавать электроны.
В промышленности активность щелочных металлов используется во многих процессах. Калий, например, является важным компонентом удобрений и используется для повышения урожайности на сельскохозяйственных угодьях. Натрий применяется в производстве стекла, моющих средствах, керамике и щелочных аккумуляторах. Литий и его соединения нашли широкое применение в производстве литиевых батарей, используемых в электронике и электротранспорте.
В научных исследованиях активность щелочных металлов вызывает интерес в связи с их способностью взаимодействовать с различными веществами и образовывать стабильные соединения. Исследования в области химии щелочных металлов позволяют понять их структуру, свойства и возможности применения в различных областях науки и технологий.
Важно отметить, что активность щелочных металлов может быть опасна из-за их высокой реактивности. Щелочные металлы, особенно натрий и калий, реагируют с водой, выделяя большое количество водорода и могут вызывать вспышки и пожары. Поэтому при работе с этими веществами необходимо соблюдать предосторожность и использовать соответствующие меры защиты.
Вопрос-ответ

Почему активность щелочных металлов увеличивается при движении вниз по периодической таблице?
Активность щелочных металлов увеличивается при движении вниз по периодической таблице из-за увеличения размера и электронной оболочки. Больший размер обозначает большую дальность межатомного взаимодействия, что увеличивает вероятность реакций с другими элементами и повышает активность.
Почему при движении вниз по периодической таблице активность щелочных металлов растет?
Активность щелочных металлов растет при движении вниз по периодической таблице, так как увеличивается количество электронов во внешней электронной оболочке. Большее количество электронов делает атомы этих элементов менее стабильными и более склонными к химическим реакциям, что повышает их активность.
В чем заключается изменение активности щелочных металлов при движении вниз по периодической таблице?
Изменение активности щелочных металлов при движении вниз по периодической таблице связано с увеличением размера, площади и объема атома, а также с увеличением количества электронов в электронной оболочке. Все эти факторы вместе приводят к увеличению вероятности реакций с другими элементами и повышению активности.
Какие изменения происходят с активностью щелочных металлов при движении вниз по периодической таблице?
При движении вниз по периодической таблице активность щелочных металлов увеличивается. Это связано с увеличением размера и объема атома, увеличением количества электронов в электронной оболочке и увеличением вероятности реакций с другими элементами. Более активные щелочные металлы имеют большую склонность к химическим реакциям и образованию соединений.
Почему активность щелочных металлов меняется при движении вниз по периодической таблице?
Активность щелочных металлов меняется при движении вниз по периодической таблице из-за изменения размеров атомов и электронных оболочек. Больший размер атома и электронной оболочки увеличивает вероятность реакций с другими элементами, поэтому активность щелочных металлов возрастает.
