Металлы — это химические элементы, которые обладают отличными физическими и химическими свойствами. Они активно взаимодействуют с другими веществами, образуя реакции. Такие реакции можно описать с помощью уравнений реакций, которые выражают взаимодействие металлов с другими веществами, такими как кислоты, соли и воды.
При взаимодействии металлов с кислотами образуются соли и освобождается водород. Например, реакция между цинком и соляной кислотой выглядит следующим образом:
Zn + 2HCl → ZnCl2 + H2
Также металлы могут реагировать с солями и образовывать другие соли, а также металлы могут взаимодействовать с водой, образуя гидроксиды и выделяя водород. Например, реакция между калием и водой выглядит следующим образом:
2K + 2H2O → 2KOH + H2
Металлы и их активность играют важную роль во многих процессах, таких как коррозия, гальванические элементы и электролиз. Понимание уравнений реакций, в которых участвуют металлы, позволяет предсказывать результаты этих реакций и использовать их в различных областях науки и промышленности.
Щелочные металлы и хлор
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью и способностью взаимодействовать с различными веществами, включая галогены. Один из таких галогенов - хлор.
В реакциях щелочных металлов с хлором обычно образуется хлорид металла. Например, литий реагирует с хлором, образуя литий хлорид. Уравнение реакции выглядит так:
2Li + Cl2 → 2LiCl
Аналогично, натрий реагирует с хлором, образуя натрий хлорид:
2Na + Cl2 → 2NaCl
Калий, рубидий и цезий также образуют соответствующие хлориды при взаимодействии с хлором.
Хлориды этих металлов являются твердыми веществами и имеют высокую температуру плавления. Они востребованы в различных отраслях промышленности и широко используются как источник хлора и щелочных металлов.
Активные металлы и кислород

Активные металлы обладают высокой реакционной способностью и способны образовывать соединения с кислородом. К таким металлам относятся, например, натрий, калий и алюминий.
Взаимодействие активных металлов с кислородом протекает в результате окислительно-восстановительной реакции. Металл окисляется, а кислород восстанавливается. При этом образуется оксид металла.
Оксиды активных металлов являются основными соединениями, обладающими высокой щелочностью. Они растворяются в воде, образуя гидроксиды, и именно поэтому активные металлы хранят в сухом состоянии, чтобы избегать их реакции с влагой.
Примером реакции активного металла с кислородом может служить реакция алюминия с кислородом в воздухе. При нагревании алюминий с горением реагирует с кислородом, образуя оксид алюминия. Уравнением реакции можно записать:
| 4Al + 3O2 → 2Al2O3 |
Из этого уравнения видно, что 4 атома алюминия реагируют с 3 молекулами кислорода, что приводит к образованию 2 молекул оксида алюминия.
В результате взаимодействия активных металлов с кислородом образуются соединения, которые могут иметь важное применение в промышленности и в повседневной жизни. Например, оксид алюминия широко используется в производстве керамики, а оксид натрия – в производстве стекла.
Реакции магния и воды

Магний - металл, который активно взаимодействует с водой. В результате этой реакции образуется газ водород и осадок гидроксида магния. Давайте более подробно рассмотрим данную реакцию и ее уравнение.
Уравнение реакции магния и воды можно записать следующим образом:
| Магний (Mg) | + | Вода (H2O) | → | Водород (H2) | + | Гидроксид магния (Mg(OH)2) |
Это уравнение показывает, что одна молекула магния реагирует с двумя молекулами воды, образуя одну молекулу водорода и одну молекулу гидроксида магния.
Во время реакции наблюдается выброс мелких пузырьков газа водорода и образование белого осадка гидроксида магния в виде порошка или нескольких мелких кристаллов.
Иногда реакция магния и воды проводится в лабораторных условиях для получения водорода в качестве побочного продукта. Водород, полученный таким образом, может быть использован в различных химических и промышленных процессах.
Взаимодействие свинца и соляной кислоты

Свинец - это химический элемент, принадлежащий к группе тяжелых металлов. Взаимодействие свинца с соляной кислотой может привести к образованию солей свинца и выделению водорода.
Уравнение реакции между свинцом и соляной кислотой можно представить следующим образом:
- Свинец (Pb) + Соляная кислота (HCl) → Соль свинца (PbCl2) + Водород (H2)
Во время реакции свинец растворяется в соляной кислоте, образуя ион свинца Pb2+. В результате сочетания иона свинца с ионами хлора Cl- образуется соль свинца PbCl2. Водород выделяется в виде газа.
Взаимодействие свинца и соляной кислоты может происходить при нагревании или погружении свинца в соляную кислоту. Процесс можно ускорить механическим перемешиванием или использованием концентрированной соляной кислоты.
Подобная реакция может иметь практическое применение в химических исследованиях, а также в процессах переработки свинца и его соединений.
Реакции алюминия с кислотами

Алюминий – это химический элемент, отличающийся высокой реакционной способностью и активностью. Взаимодействие алюминия с кислотами является одной из основных реакций, которые могут происходить с этим металлом.
Среди наиболее значимых реакций алюминия с кислотами следует отметить взаимодействие с соляной кислотой, серной кислотой и солями фосфорной кислоты.
Взаимодействие алюминия со соляной кислотой приводит к образованию соли алюминия и выделению водорода:
- Al + HCl → AlCl3 + H2
В реакции алюминия с серной кислотой образуется сульфат алюминия и выделяется серный газ:
- 2Al + 3H2SO4 → Al2(SO4)3 + 3H2S
Алюминий также реагирует с солью фосфорной кислоты, что приводит к образованию соответствующего солевого соединения и освобождению фосфористого водорода:
- 3Al + 2H3PO4 → Al2(PO4)3 + 3H2
Таким образом, взаимодействие алюминия с различными кислотами приводит к образованию солей и выделению газов. Эти реакции характеризуются как растворимые реакции и широко используются в химической промышленности и лабораторной практике.
Взаимодействие железа и серной кислоты
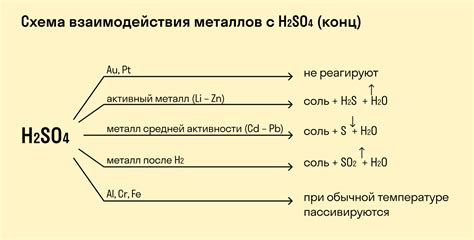
Взаимодействие железа и серной кислоты является одной из важных реакций, которые происходят между металлом и кислотой. Железо обладает достаточно высокой активностью, поэтому может реагировать с различными кислотами, включая серную кислоту.
При этом реакции протекают с образованием соответствующих солей и выделением водорода. Серная кислота (H2SO4) вступает в реакцию с железом (Fe) и образует соль серной кислоты – сульфат железа (FeSO4) и выделяется водород (H2).
Уравнение реакции можно записать следующим образом:
Fe + H2SO4 → FeSO4 + H2
Эта реакция является одной из наиболее распространенных реакций в химической лаборатории. Сульфат железа является важным промышленным продуктом, который находит применение в различных отраслях промышленности, таких как металлургия, сельское хозяйство и производство удобрений.
Также важно отметить, что данная реакция протекает с выделением газа водорода. Восстановительные свойства железа позволяют ему вытеснять водород из серной кислоты. Выделение газа можно наблюдать в виде пузырьков, которые возникают при проведении данной реакции.
Окисление цинка щелочами

Окисление цинка щелочами — это химическая реакция, при которой цинк вступает во взаимодействие с щелочным раствором и окисляется. Эта реакция может происходить при взаимодействии цинка с щелочами, например, гидроксидом натрия или гидроксидом калия.
Окисление цинка щелочами происходит по следующему уравнению реакции:
- Цинк реагирует с гидроксидом натрия:
- Цинк реагирует с гидроксидом калия:
| Zn + 2NaOH → Na2ZnO2 + H2O |
| Zn + 2KOH → K2ZnO2 + H2O |
В обоих случаях цинк окисляется, а щелочи — гидроксид натрия или гидроксид калия, — действуют как окислительные агенты в реакции. При окислении цинка образуются соответствующие соли снотрия или калия — натрийцинкит или калийцинкит, и образуется вода.
Окисление цинка щелочами может использоваться в промышленности и лабораторных условиях для получения различных химических соединений цинка и его оксидов. Также эта реакция является одним из способов утилизации отходов, содержащих цинк, например, различных цинковых соединений или изделий, содержащих цинк.
Вопрос-ответ

Какие металлы считаются активными?
К активным металлам относятся щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) и щелочноземельные металлы (бериллий, магний, кальций, стронций, барий, радий). Также активными считаются алюминий, цинк, железо, свинец, никель, титан и другие.
Каким образом происходят реакции активных металлов с водой?
Реакция активных металлов с водой протекает с образованием соответствующего гидроксида и выделением водорода. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению молекулярного водорода:
Как происходит реакция пассивного железа с кислородом?
Пассивное железо не реагирует с кислородом при обычных условиях. Однако при нагревании до высоких температур или в растворе кислород может окислить железо до оксида железа(III) или других оксидов железа.
Какие металлы обладают самой серьезной реакционной способностью?
Самой серьезной реакционной способностью обладают щелочные металлы - литий, натрий, калий, рубидий, цезий и франций. Они очень активно взаимодействуют с водой, кислородом и другими веществами, выделяя много энергии.
