Реакция металлов с кислотами - одна из основных реакций, которые изучаются в химическом образовании. Эта реакция позволяет наглядно продемонстрировать химическую активность металлов и их способность образовывать ионные соединения.
В ходе такой реакции металл реагирует с кислотой, выделяясь газ и образуя соль. Обычно в процессе реакции металл замещает водород в молекуле кислоты, что и приводит к образованию соли и выделению газа.
Например, реакция цинка с соляной кислотой:
Zn + 2HCl -> ZnCl2 + H2
Реакция металлов с кислотами имеет широкий спектр применений. В промышленности эта реакция используется, к примеру, при производстве хлорида железа(II) с использованием железа и соляной кислоты. А также в процессах очистки воды, при которых металлические шарики, покрытые палладием, обеспечивают удаление катализаторов из отработанных топлив, что способствует более эффективному использованию энергоносителей и меньшему выбросу вредных веществ в окружающую среду.
Также, реакции металлов с кислотами могут использоваться в качестве учебного материала для обучения химии. Они помогают понять основные законы химических реакций, свойства и активность металлов, а также влияние различных факторов на процессы образования соединений.
Влияние кислот на металлы и их практическое применение

Взаимодействие металлов с кислотами имеет значительное практическое значение и находит широкое применение в различных отраслях промышленности и науки.
Кислоты повышают активность металлов и могут вызывать их реакцию. Например, хлористоводородная кислота обладает сильным коррозионным действием, что позволяет ей применяться в различных процессах очистки металла от загрязнений. Нитратная кислота используется в пищевой промышленности для обработки металлических поверхностей и предотвращения окисления. Серная кислота активно применяется в процессе гальванического покрытия металлами для создания защитного слоя и улучшения внешнего вида изделий.
Реакция металлов с кислотами находит свое применение также в процессе получения водорода. Многие металлы реагируют с различными кислотами, выводя водород. Этот процесс используется для получения водорода в химической промышленности, а также в энергетике для использования в топливных элементах и производстве электроэнергии.
Кроме того, реакция металлов с кислотами имеет применение в аналитической химии. Этот метод позволяет определить содержание металлов в различных образцах, таких как пищевые продукты, почва, вода и т.д. Результаты анализов могут быть использованы для контроля качества и безопасности продуктов питания, оценки экологической ситуации и других целей.
Таким образом, взаимодействие металлов с кислотами имеет широкие практические применения и значимость в различных областях. Оно позволяет использовать металлы в процессах очистки, защиты и получения веществ, а также анализировать и контролировать содержание металлов в различных средах.
Взаимодействие металлов с кислотами: процесс и причины

Взаимодействие металлов с кислотами является одной из основных реакций, которые возникают при контакте металла с кислотным раствором. Это процесс, в результате которого образуются соли металлов и выделяется водород.
Причинами реакции металлов с кислотами являются химические свойства как металлов, так и кислот. Металлы обладают активностью, которая зависит от их положения в электрохимическом ряду. Как правило, активные металлы, такие как натрий, калий, алюминий, реагируют с кислотами, образуя соли и выделяя водород.
Кислоты, в свою очередь, являются ионными соединениями, в которых положительными ионами являются водородные ионы. При контакте с металлами, эти ионы образуют водородный газ при выделении энергии.
Важно отметить, что реактивность металла и кислоты также зависит от их концентрации и окружающих условий. Например, некоторые металлы могут реагировать только с концентрированными кислотами, в то время как другие металлы могут реагировать даже с разбавленными кислотами.
Взаимодействие металлов с кислотами имеет широкое применение в различных областях, включая химическую промышленность, производство металлов, электрохимию и даже медицину. Например, реакция цинка с кислотой может использоваться для получения водорода в лаборатории или водородных станциях для использования в автомобилях с водородным двигателем.
Список некоторых реакций металлов с кислотами:
- Цинк + соляная кислота -> солянокислый цинк + водород
- Алюминий + серная кислота -> алюмосульфат + водород
- Магний + хлороводородная кислота -> хлорид магния + водород
- Железо + серная кислота -> сульфат железа + водород
Все эти реакции являются примерами взаимодействия металлов с кислотами и демонстрируют, как процессы химической реакции могут использоваться для получения различных продуктов и веществ.
Химические свойства металлов при контакте с кислотами
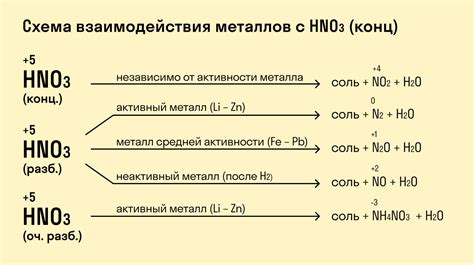
Металлы имеют различные химические свойства при контакте с кислотами. Некоторые металлы активно взаимодействуют с кислотами, при этом выделяется водород и образуются соответствующие соли. Такое взаимодействие обусловлено тем, что металл может отдавать электроны, образуя положительно заряженные ионы, а кислота принимает эти электроны, образуя отрицательно заряженные ионы.
Например, при воздействии на цинк (Zn) соляной кислоты (HCl) образуется хлорид цинка (ZnCl2) и выделяется водород (H2):
$$Zn + 2HCl
ightarrow ZnCl2 + H2$$
Медь (Cu) также реагирует с соляной кислотой, при этом образуется хлорид меди (CuCl2) и выделяется водород:
$$Cu + 2HCl
ightarrow CuCl2 + H2$$
Однако, некоторые металлы, такие как золото (Au), платина (Pt) и другие, не реагируют с кислотами, так как они являются химически инертными и не способны отдавать электроны.
Это свойство металлов при контакте с кислотами широко используется в различных областях, например, при производстве водорода, металлических солей, гальванической обработке поверхностей и других процессах, где требуется активное взаимодействие металла с кислотой.
Виды реакций металлов с кислотами и их применение в процессах

1. Окислительно-восстановительная реакция: Реакция металлов с кислотами может протекать как окислительно-восстановительная реакция, при которой металл окисляется, а водород, выделяющийся при реакции, восстанавливает другие вещества. Такие реакции часто применяются для получения водорода в химической лаборатории и в промышленности, а также для синтеза различных органических и неорганических веществ с использованием водорода в качестве реагента.
2. Образование солей: Реакция металлов с кислотами часто приводит к образованию солей – химических соединений, в которых катионом выступает металл, а анионом – кислотный остаток. Такие соли могут находить применение в различных отраслях промышленности, например, в фармацевтической, пищевой и сельском хозяйстве в качестве добавок в препаратах, пищевых продуктах и удобрениях.
3. Выделение газов: Многие реакции металлов с кислотами сопровождаются выделением газов. Например, реакция цинка с соляной кислотой приводит к выделению водорода, а реакция магния с соляной кислотой – к выделению хлора. Такие газы могут быть использованы в промышленности и научных исследованиях, например, для проведения анализов или в качестве реагентов при получении различных веществ.
4. Передача электронов: Реакции металлов с кислотами, особенно сильные окислители, могут приводить к передаче электронов между металлом и кислотой. При этом металл становится положительно заряженным и образует ионы, которые могут быть использованы для выполнения различных химических процессов или используются в качестве катализаторов для ускорения реакций.
5. Процессы получения энергии: Некоторые реакции металлов с кислотами могут протекать с выделением энергии в виде тепла или электричества. Это свойство используется в различных устройствах, таких как гальванические элементы и аккумуляторы, для получения электрической энергии.
Роль реакции металла и кислоты в повседневной жизни

1. Производство и хранение пищевых продуктов.
Реакция металлов с кислотами играет важную роль в производстве и хранении пищевых продуктов. Например, при консервировании пищевых продуктов кислота реагирует с металлической оболочкой контейнера, предотвращая развитие бактерий и гниения. Это помогает продлить срок годности продукта и сохранить его качество.
2. Бытовая химия.
Реакция металлов с кислотами также используется в бытовой химии. Например, многочисленные металлические клещи и зажимы, которые используются для закрепления предметов, часто покрыты специальным материалом, содержащим кислоту. Это позволяет им прочно держаться на поверхностях и не соскальзывать, обеспечивая удобство и безопасность в повседневной жизни.
3. Водоочистка.
Реакция металлов с кислотами используется также в водоочистке. Кислоты могут быть использованы для удаления ржавчины и отложений, образующихся в водопроводных трубах и системах очистки воды. Это помогает обеспечить качество питьевой воды и предотвратить повреждение инженерных коммуникаций.
4. Добывающая промышленность.
Реакция металлов с кислотами играет значительную роль в добывающей промышленности. Кислоты могут использоваться для растворения минералов и выделения полезных веществ из руды. Например, связка кислоты и металла может быть использована для обработки руды, при процессе извлечения золота. Это позволяет получать ресурсы, необходимые для производства различных материалов и энергии.
5. Электротехника и электроника.
В электротехнике и электронике реакция металла и кислоты играет важную роль. Например, при пайке электронных компонентов на печатные платы используется кислота, чтобы удалить окисленные слои с поверхности металла и обеспечить хороший контакт. Также кислоты могут быть использованы для чистки и ухода за электронными устройствами, предотвращая коррозию и повреждение контактов.
Применение реакции металлов с кислотами в научных и промышленных целях
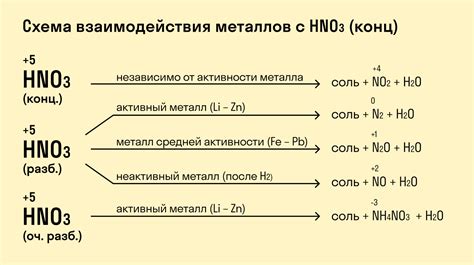
1. Изучение химических свойств металлов
Реакция металлов с кислотами позволяет исследовать их химические свойства. Продукты реакции и скорость ее протекания могут указывать на степень активности металла. Например, реакция цинка с соляной кислотой происходит с выделением водорода и образованием соли цинка. Это свидетельствует о высокой активности цинка и его склонности к окислению. Такие данные могут быть использованы для классификации и сравнения различных металлов.
2. Получение металлических соединений
Реакция металлов с кислотами используется для получения металлических соединений. Например, обработка железа соляной кислотой позволяет получить хлорид железа, который широко применяется в промышленности для получения различных железосодержащих соединений. Также реакция алюминия с соляной кислотой приводит к образованию соли алюминия, которая используется в производстве различных материалов, а также в лекарственной промышленности.
3. Очистка металлов
Реакция металлов с кислотами может использоваться для очистки металлов от примесей, оксидов и других загрязнений. В результате реакции эти вещества растворяются в кислоте, а чистый металл остается. Например, реакция меди с серной кислотой позволяет очистить ее от оксидов и получить чистую медь для дальнейшего использования в производстве электрических проводов, изделий и других изделий из меди.
4. Полезное использование реакционных продуктов
Продукты реакции металлов с кислотами могут иметь практическое применение. Например, водород, выделяющийся при реакции металлов с кислотами, может быть использован как источник энергии или в процессе производства аммиака и других химических соединений. Кислотные соли, образующиеся в результате реакции, могут быть использованы в производстве удобрений, пищевых добавок и других продуктов.
Главные результаты реакции металла с кислотой для использования в различных отраслях

1. Получение водорода. Реакция металлов с кислотами приводит к выделению водорода, который имеет широкое применение в различных отраслях. Например, водород используется в химической промышленности для синтеза аммиака, метанола и других органических соединений.
2. Получение солей. Реакция металла с кислотой приводит к образованию солей, которые широко используются в различных областях, включая фармацевтику, пищевую промышленность и сельское хозяйство. Например, соли меди, цинка и железа могут использоваться в качестве питательных добавок и микроэлементов для растений и животных.
3. Очистка металлов. Реакция металлов с кислотами может использоваться для очистки и обработки различных металлических поверхностей. Например, растворяя оксиды и соли с помощью кислоты, можно удалить загрязнения и окисленные слои с поверхностей металлических изделий.
4. Нанотехнологии. Реакция металла с кислотой может быть использована в процессе синтеза наноматериалов. Например, с помощью реакции металлического наночастицы с кислотой можно получить наноматериалы с определенными свойствами, такими как поверхностная активность, катализ и электрическая проводимость.
5. Энергетика. Реакция металла с кислотой может быть использована в процессе получения энергии. Например, реакция алюминия с кислотой может привести к выделению большого количества энергии, что может быть использовано в ракетостроении и других областях, где требуется высокая энергетическая отдача.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Реагируют с кислотами активные металлы, такие как натрий, калий, магний, кальций и др. Также реагируют с кислотами некоторые переходные металлы, например, цинк и железо.
Каковы применения реакции металлов с кислотами?
Реакция металлов с кислотами широко применяется в различных областях. Например, она используется в химии для получения солей металлов, которые могут быть использованы в разработке катализаторов, промышленных процессах и производстве лекарств. Эта реакция также является основой для получения важных химических элементов, таких как водород и азот.
