Металлы являются важными элементами в химии и обладают различными свойствами. Одно из самых интересных свойств металлов - их способность взаимодействовать с окружающей средой и изменять свой степень окисления.
Ионы металлов могут вести себя как окислители или восстановители в химических реакциях. В качестве окислителей они способны приобретать дополнительные электроны, а в качестве восстановителей могут отдавать электроны другим веществам. Такие реакции играют важную роль во многих процессах, в том числе в электрохимии и каталитических реакциях.
Ионы металлов могут изменять свою степень окисления благодаря своей электронной структуре и химическим свойствам. Изменение степени окисления позволяет металлам выполнять различные функции и играть роль в различных реакциях. Например, в качестве окислителей они способны окислять другие вещества, освобождая электроны, и в качестве восстановителей - получать электроны, чтобы снизить свою степень окисления.
Что такое ионы металлов
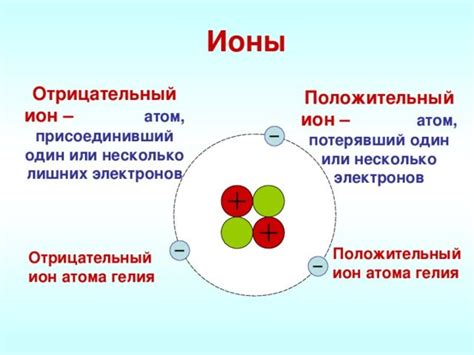
Ионы металлов - это атомы металлов, которые обладают положительным зарядом. При взаимодействии с другими веществами ион металла может выступать как окислитель или восстановитель.
Окислительные свойства ионов металлов проявляются в их способности получать электроны от других веществ. При этом ионы металлов окисляются, теряют электроны и образуют положительный заряд. Примером ионов-окислителей являются феррий (Fe3+), медь (Cu2+) и марганец (Mn4+).
В то же время, некоторые ионы металлов обладают восстановительными свойствами. Они способны передавать электроны другим веществам и при этом снижать свой положительный заряд. Примерами ионов-восстановителей являются железо (Fe2+), цинк (Zn2+) и медь (Cu+).
Ионы металлов широко используются в химической промышленности, металлургии, электротехнике и медицине. Они играют важную роль в реакциях окисления и восстановления, а также в электрохимических процессах, таких как гальваническая коррозия и электролиз.
Важно учитывать окислительно-восстановительные свойства ионов металлов при работе с ними, так как они могут оказывать значительное влияние на реакции, проходящие в системе.
Ионы металлов как окислители

Ионы металлов играют важную роль в процессах окисления и восстановления, исполняя функцию окислителей. В химии окислитель – вещество, которое передает электроны другому веществу. Ионы металлов обладают способностью отдавать электроны и при этом самостоятельно превращаться в ионы меньшей степени окисления.
Наиболее известным примером ионов металлов, выступающих в качестве окислителей, являются ионы железа Fe2+ и меди Cu2+.
Ион железа Fe2+ имеет возможность отдавать два электрона, так как в его внешней оболочке находится два свободных электрона. При этом ион железа сам становится ионом более высокой степени окисления Fe3+, отдавая электроны другому веществу.
Ионы меди Cu2+ также способны отдавать два электрона, превращаясь при этом в ионы меди меньшей степени окисления Cu+.
Ионы металлов, выступая в роли окислителей, часто взаимодействуют с веществами, которые выступают в роли восстановителей. Процесс окисления-восстановления между ионами металлов и веществами, выступающими в роли окисляемых веществ, активно применяется в многих химических реакциях и процессах, включая реакции синтеза органических соединений и электрохимические реакции.
Влияние ионов металлов на окружающую среду

Ионы металлов могут иметь разнообразное воздействие на окружающую среду и биологическую систему. Они могут быть как полезными, так и вредными для живых организмов и экосистем в целом.
Одной из основных проблем, связанных с ионами металлов, является загрязнение водных ресурсов. Выбросы ионов металлов в реки, озера и океаны могут приводить к их накоплению в водных организмах и последующему нарушению экологического баланса.
Некоторые ионы металлов, такие как ртуть, кадмий и свинец, являются крайне токсичными и могут вызывать серьезные заболевания у животных и людей. Эти ионы могут аккумулироваться в организмах и передаваться по пищевой цепи, достигая опасных концентраций.
В то же время, некоторые ионы металлов могут быть полезными для биологических процессов. Например, железо является необходимым микроэлементом для образования гемоглобина, который отвечает за транспортировку кислорода в организме. Без достаточного количества железа человек может страдать от анемии.
Для снижения негативного влияния ионов металлов на окружающую среду необходимо внедрять современные методы очистки воды и воздуха от загрязнений. Также важно строго контролировать выбросы ионов металлов в окружающую среду при проведении промышленных процессов и добывающей деятельности.
В заключение, влияние ионов металлов на окружающую среду может быть как положительным, так и отрицательным. Необходимо балансировать использование металлов, чтобы минимизировать их негативное воздействие на окружающую среду и здоровье живых организмов.
Ионы металлов как восстановители

Ионы металлов в органической и неорганической химии играют важную роль как восстановители. Восстановительные свойства ионов металлов основаны на их способности передавать электроны на другие атомы или ионы, что позволяет изменять их окислительное состояние.
В органической химии ионы металлов используются, например, для проведения редукционных реакций. Они могут служить катализаторами при различных органических превращениях, таких, как гидрирование, гидрогенирование, дезгидратация и другие. Ионы металлов обладают способностью принимать или отдавать электроны, что позволяет им участвовать в реакциях восстановления органических соединений.
Одним из примеров ионов металлов, выступающих в роли восстановителей, являются катионы железа. Они широко используются в биохимических процессах организмов, включая перенос электронов во время дыхания и фотосинтеза. Катионы железа могут принимать и отдавать электроны, что позволяет им участвовать во многих важных биологических реакциях.
Ионы металлов также используются как восстановители в неорганической химии. Например, в различных электрохимических процессах, таких, как электролиз или аккумуляторные реакции, ионы металлов могут служить источником электронов для восстановления других веществ. Одним из примеров может быть использование ионов цинка в аккумуляторных батареях, где они восстанавливаются и окисляются, осуществляя перенос электронов и создавая электрический ток.
Использование ионов металлов в химических реакциях

Ионы металлов играют важную роль в химических реакциях, так как они могут выступать в качестве окислителей или восстановителей. Окислительные и восстановительные реакции являются ключевыми процессами в химии и имеют широкое применение в различных областях науки и техники.
Окислители - это вещества, которые получают электроны от вещества, вступающего в реакцию. В процессе окисления они сами вступают в восстановительную реакцию, что позволяет им играть роль активных агентов в различных процессах. Ионы металлов могут служить окислителями и, получая электроны, часто меняют свою окислительную степень.
Восстановители, наоборот, передают электроны другим веществам в реакции окисления. Ионы металлов могут выступать в роли восстановителей, обеспечивая электронный перенос и инициируя различные химические превращения. Некоторые ионы металлов имеют высокую активность в восстановительных реакциях и широко применяются в промышленности и лабораторных исследованиях.
Использование ионов металлов в химических реакциях имеет широкий спектр применения. Например, они могут быть использованы в качестве катализаторов реакций, ускоряя процесс обмена электронами между веществами. Ионные реакции металлов могут также играть роль в электрохимических процессах, таких как электролиз, батареи и аккумуляторы.
В заключении, ионы металлов играют важную роль в химических реакциях как окислители и восстановители. Они участвуют в множестве процессов, обеспечивая электронный перенос и инициируя химические превращения. Использование ионов металлов открывает новые возможности в области катализа, электрохимии и других химических технологий.
Примеры ионов металлов
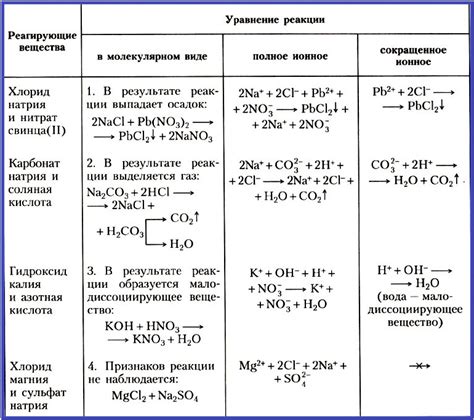
1. Натрий (Na): Натрий образует ион Na+, который является окислителем. В реакциях окисления на ион натрия переходит один электрон и он претерпевает превращение в натриевый катион. Натрий часто вступает в реакции восстановления, поглощая электроны и превращаясь в натриевую соль.
2. Железо (Fe): Железо может образовывать два различных иона: Fe2+ и Fe3+. Ион железа Fe2+ является одним из наиболее распространенных восстановителей, поскольку он может отдавать два электрона. Ион железа Fe3+ в свою очередь является мощным окислителем, поскольку он имеет возможность принимать электроны.
3. Медь (Cu): Медь способна образовывать два типа ионов: Cu+ и Cu2+. Ион меди Cu+ является окислителем и способен принимать электроны, при этом превращаясь в ион меди Cu2+. Ион меди Cu2+ в свою очередь является восстановителем и способен отдавать электроны.
4. Свинец (Pb): Свинец может образовывать ионы Pb2+ и Pb4+. При окислении ион свинца Pb2+ превращается в ион свинца Pb4+, при этом принимая два электрона. Ион свинца Pb4+ является окислителем и может отдавать электроны, в результате чего превращается в ион свинца Pb2+.
5. Цинк (Zn): Цинк образует ион Zn2+, который является окислителем. В реакциях окисления ион цинка принимает два электрона и превращается в ион цинка Zn2+, который имеет положительный заряд.
6. Алюминий (Al): Алюминий образует ион Al3+, который может вступать в реакции окисления. Ион алюминия Al3+ принимает три электрона и становится алюминиевым катионом.
7. Марганец (Mn): Марганец может образовывать два вида ионов: Mn2+ и Mn7+. Ион марганца Mn2+ является восстановителем и может отдавать электроны. Ион марганца Mn7+ в свою очередь является окислителем и способен принимать электроны.
Таким образом, ионы различных металлов в реакциях могут выступать как окислители или восстановители, что делает их важными участниками многих химических процессов.
Какие металлы могут образовывать ионы
Металлы являются элементами периодической таблицы, обладающими особыми свойствами, включая способность образовывать ионы. Ионы металлов могут быть положительно заряженными, так как они теряют один или несколько электронов при взаимодействии с другими веществами.
В периодической таблице наиболее известными металлами, способными образовывать ионы, являются щелочные и щелочноземельные металлы. Щелочные металлы, такие как литий, натрий и калий, имеют один электрон во внешней оболочке, который легко отдают, образуя ионы с одноименными зарядами +1. Щелочноземельные металлы, такие как магний, кальций и стронций, имеют два электрона во внешней оболочке и образуют ионы с зарядом +2.
Однако не только щелочные и щелочноземельные металлы способны образовывать ионы. Многие другие металлы, такие как железо, медь, цинк и алюминий, также могут образовывать ионы. Они имеют разное количество электронов во внешней оболочке, и их заряды могут быть различными.
Ионы металлов играют важную роль в химических реакциях, так как они могут участвовать в окислительно-восстановительных процессах. Они могут служить как окислителями, получая дополнительные электроны, или как восстановителями, отдавая свои электроны. Это свойство ионов металлов позволяет им участвовать в множестве химических реакций и образовывать различные соединения.
Преимущества и недостатки использования ионов металлов

Преимущества:
- Высокая электропроводность: ионы металлов являются хорошими электропроводниками, что позволяет использовать их в различных электронных устройствах и электрических цепях.
- Каталитическая активность: ионы металлов могут действовать как каталитические центры, ускоряя химические реакции. Это важно в промышленности, где использование металлов в качестве катализаторов позволяет экономить время и ресурсы.
- Магнитные свойства: некоторые металлы обладают магнитными свойствами, что позволяет использовать их в производстве магнитных материалов, электромагнитов и сенсоров.
- Устойчивость к коррозии: многие металлы обладают высокой устойчивостью к коррозии, что позволяет использовать их в строительстве, производстве металлических конструкций, автомобилей и т.д.
Недостатки:
- Токсичность: некоторые металлы могут быть токсичными и вызывать отравление при длительном контакте или поступлении в организм. Поэтому необходимо соблюдать меры предосторожности при использовании таких металлов.
- Высокая плотность: многие металлы обладают высокой плотностью, что делает их тяжелыми и неудобными для использования в некоторых сферах, например, в авиастроении.
- Цена: некоторые металлы являются дорогими и редкими, что делает их не всегда доступными для использования в промышленности или производстве. Это может повлиять на стоимость и доступность конечных продуктов.
- Склонность к окислению: некоторые металлы имеют склонность к окислению, что может привести к потере их полезных свойств и деградации материала со временем.
Вопрос-ответ

Что такое ионы металлов?
Ионы металлов - это заряженные частицы, состоящие из атомов металла, которые потеряли или приобрели один или несколько электронов. Они обладают положительным зарядом и могут участвовать в различных химических реакциях в связи с этим зарядом.
Каким образом ионы металлов могут действовать как окислители?
Ионы металлов могут действовать как окислители, перенося электроны на другие вещества. Они способны окислиться, то есть потерять один или несколько электронов, передавая их другим веществам, которые при этом восстанавливаются. Это происходит в окислительно-восстановительных реакциях.
Каким образом ионы металлов могут действовать как восстановители?
Ионы металлов могут действовать как восстановители, принимая на себя электроны от других веществ. Они способны восстановиться, то есть приобрести один или несколько электронов, путем их получения от окисленных веществ. Такие реакции также происходят в окислительно-восстановительных процессах.
Какие металлы могут действовать как окислители?
Многие металлы могут действовать как окислители. Например, железо, медь, цинк, алюминий и другие металлы способны передавать электроны другим веществам, окисляясь при этом. Такие металлы обычно имеют большую электроотрицательность и легко отдают электроны.
Какие металлы могут действовать как восстановители?
Многие металлы могут действовать как восстановители. Например, марганец, хром, титан, никель и другие металлы способны принимать на себя электроны от окисленных веществ, восстанавливаясь при этом. Такие металлы обычно имеют меньшую электроотрицательность и легко принимают электроны.
