В мире химии и физики существует интересное явление, объясняющее почему ионы металла всегда заряжены. Металлы, такие как железо, алюминий, медь и другие, обладают высокой проводимостью электричества благодаря своим свободным электронам. Однако, при переходе металла в ионное состояние, эти свободные электроны теряются и возникает вопрос о заряде ионов.
Объяснение этого явления заключается во взаимодействии электронов и ядер атомов металла. Когда металл находится в молекулярном состоянии, электроны свободно двигаются внутри общей плотной структуры. Однако, когда вещество подвергается физическому или химическому воздействию, некоторые электроны могут покинуть атомы и перейти в межатомный пространство, создавая положительно заряженные ионы.
При этом, каждый ион металла всегда обладает определенным зарядом, который обусловлен числом электронов, потерянных или приобретенных атомом. Ионы могут иметь положительный заряд, если атом отдал свои электроны, или отрицательный заряд, если атом принял дополнительные электроны от других атомов. Таким образом, заряд ионов металла всегда является результатом перераспределения электронов в атомах металла.
Понимание этого явления имеет важное практическое значение в различных областях науки и техники. Это позволяет нам лучше понять поведение металлов в различных реакциях и процессах, а также использовать металлы с определенными зарядами и свойствами в различных целях. Например, ионы металла могут использоваться в электролитических процессах, в производстве аккумуляторов или в металлургической промышленности.
Почему ионы металла всегда заряжены: объясняем явление

Ионы металла, в отличие от атомов металла, имеют заряд. Это происходит из-за особенностей строения металлической структуры и химической связи в металлах. Ионы металла образуются, когда один или несколько электронов покидают внешний энергетический уровень атома металла и становятся свободными. В результате этого процесса атомы металла обретают положительный заряд, становясь ионами.
Основной причиной образования заряженных ионов металла является их способность отдавать внешние электроны. Металлы характеризуются низкой электроотрицательностью, что означает, что они имеют слабую способность удерживать электроны на своих энергетических уровнях. Поэтому при воздействии внешних условий, например, при контакте с химически активным веществом или при поглощении энергии, электроны могут легко переходить с атомов металла на энергетические уровни других атомов, создавая заряженные ионы в процессе.
Образование заряженных ионов металла является важным свойством металлической химии. Заряженные ионы металла обладают специфическими свойствами и способностью участвовать в различных химических реакциях, образуя химические соединения с другими веществами. Это позволяет ионам металла играть важную роль в формировании структуры и свойств различных материалов, таких как сплавы, растворы и кристаллы.
В заключение, образование заряженных ионов металла объясняется их способностью отдавать внешние электроны и слабой электроотрицательностью металлов. Однако, чтобы точнее понять механизм образования ионов металла и их влияние на химические реакции и свойства материалов, требуется более глубокое исследование и изучение металлической химии.
Явление ионизации в металлах
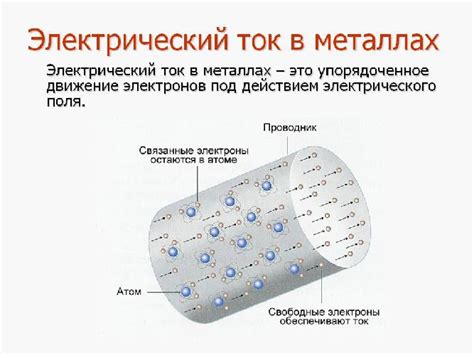
Ионизация - это процесс, в результате которого атомы металла теряют или приобретают один или несколько электронов, превращаясь в ионы с положительным или отрицательным зарядом. В металлах преобладает ионизация с образованием ионов положительного заряда.
На поверхности металла присутствует слой электронов, называемый электронным облаком. Эти электроны могут свободно двигаться внутри металла, образуя так называемые свободные электроны. Они являются носителями электрического заряда и создают электрический ток в металле.
При повышении температуры или других внешних воздействиях, энергия электронов внутри металла может быть достаточной для превращения их в свободные электроны. В результате происходит ионизация металла, когда электроны покидают атом и образуют свободные ионы положительного заряда.
Ионизация металла является важным явлением в различных процессах, таких как электролиз, электропроводность и многие другие. Она объясняет такие ключевые свойства металлов, как их способность проводить электрический ток и тепло.
Важно отметить, что ионизация металла зависит от его химической структуры и особенностей атомной структуры. Разные металлы могут иметь различные степени ионизации и разные свойства, связанные с этим явлением.
Механизм образования ионов в металлах

Ионизация металлов является ключевым явлением, определяющим их химические свойства. В металлах атомы обладают свободными электронами, которые могут передвигаться по всей структуре кристаллической решетки.
Механизм образования ионов в металлах основан на процессе окислительной реакции, в ходе которой атомы металла отдают один или несколько электронов. Это происходит из-за того, что энергия связи электронов в металле ниже, чем энергия связи с другими атомами или молекулами. Это позволяет металлам образовывать положительно заряженные ионы, лишившись своих внешних электронов.
Число электронов, передаваемых металлом, зависит от его электроотрицательности и валентности. Металлы с низкой электроотрицательностью, такие как щелочные металлы, способны отдать один электрон и образовывать однозарядные положительные ионы. Металлы с более высокой электроотрицательностью, например, переходные металлы, могут образовывать ионы с разной валентностью.
Образование ионов в металлах имеет важное значение для их реакции с другими веществами. Положительно заряженные ионы металла способны притягивать отрицательно заряженные атомы или группы атомов, образуя химические соединения. Это обуславливает способность металлов образовывать соли, амфотерные оксиды и другие химические соединения.
Возможные причины зарядки ионов металла
Зарядка ионов металла является результатом особенностей строения атомов металла и их взаимодействия с окружающими частицами. Вот несколько возможных причин, объясняющих почему ионы металла всегда заряжены:
- Электронная оболочка. Металлические атомы имеют оболочку из электронов, которые свободно движутся по металлической решетке. Это свободное движение электронов обусловливает электропроводность металлов. Однако, когда атом теряет или получает электрон, то образуется ион с положительным (катион) или отрицательным (анион) зарядом. Процесс образования ионов связан с распределением электронов на энергетических уровнях атома.
- Энергетические уровни. Когда атом металла теряет или получает электрон, то происходят изменения в энергетических уровнях атома. Если атом переходит на энергетический уровень с более высокой энергией, он становится ионом с отрицательным зарядом (анион). Если атом переходит на энергетический уровень с более низкой энергией, он становится ионом с положительным зарядом (катион).
- Химические связи. Ионы металла могут образовывать химические соединения с другими ионами или молекулами. В таких соединениях ионы металла могут иметь различные заряды, в зависимости от их взаимодействия с другими частицами. Например, в сложных соединениях ионы металла могут образовывать комплексы с анионами или молекулами, что также влияет на их заряд.
- Электростатические силы. Ионы металла всегда заряжены, потому что существуют электростатические силы, притягивающие их к другим заряженным частицам. Например, катионы металла могут притягиваться к анионам других веществ, создавая химическую связь или образуя растворимые соли. Такие электростатические силы способствуют образованию стабильных ионных соединений.
Все эти факторы объясняют, почему именно ионы металла всегда заряжены. Благодаря своей зарядке, ионы металла могут взаимодействовать с другими частицами, образуя различные химические соединения и проявляя разнообразные свойства при контакте с окружающей средой.
Влияние окружающей среды на заряд ионов металла

Заряд ионов металла зависит от химической реакции, происходящей между металлом и окружающей средой. Взаимодействие с субстратом или растворителем может приводить к изменению заряда ионов металла.
Окружающая среда может влиять на заряд ионов металла через процессы окисления и восстановления. В некоторых случаях металл может отдавать или принимать электроны, что приводит к изменению его заряда. Например, в растворе металл может окисляться, увеличивая свой заряд, или восстанавливаться, уменьшая его.
Кроме того, окружающая среда может влиять на заряд ионов металла через образование комплексов. В таких случаях металл может формировать стабильные комплексы с другими молекулами или ионами, что также приводит к изменению его заряда. Например, металл может образовывать комплексы с водными молекулами или органическими соединениями, что позволяет регулировать его заряд в зависимости от условий окружающей среды.
Таким образом, окружающая среда играет важную роль в определении заряда ионов металла. Взаимодействие с растворителем или субстратом, процессы окисления и восстановления, а также формирование комплексов - все эти факторы могут оказывать влияние на заряд ионов металла и определять его химические свойства и активность в реакциях.
Ионная связь и заряд иона металла
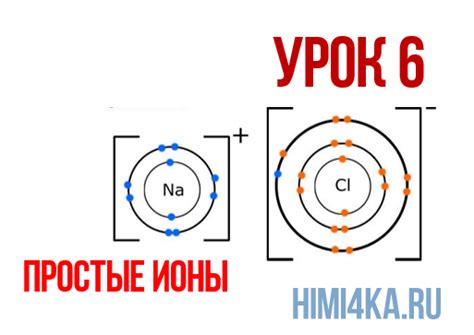
Ионная связь - это тип химической связи, возникающий между атомами, когда один атом отдает один или несколько электронов другому атому. В результате формируются ионы – заряженные атомы или группы атомов.
Металлические элементы характеризуются тем, что они способны образовывать ионы положительного заряда – катионы. В основе образования катионов лежит отдача электронов в валентной оболочке металлического атома. Это происходит при окислении металла, когда он теряет один или несколько электронов во внешней оболочке. Таким образом, ионы металла всегда обладают положительным зарядом.
Заряд иона металла может быть разным и зависит от валентности данного металла. Валентность - это количество электронов, которые металл может отдать при образовании иона. Например, железо (Fe) может образовывать два вида ионов: Fe2+ (ферроцион) и Fe3+ (феррицион), что связано с наличием у атома железа двух и трех электронов в валентной оболочке соответственно.
Таким образом, ионы металла всегда заряжены, так как процесс образования ионов связан с потерей или приобретением электронов, что приводит к образованию заряда у ионов металла.
Влияние заряженности ионов металла на химические реакции

Заряженность ионов металла играет важную роль в химических реакциях. Металлы имеют тенденцию образовывать ионы путем отдачи или приобретения электронов. Это позволяет им создавать стабильную электрическую зарядку, которая влияет на их химическое поведение.
Заряженность ионов металла определяет их способность формировать соединения с другими веществами. Когда в реакции участвуют ионы металла с положительной зарядкой, они могут образовывать ионы с отрицательной зарядкой, обеспечивая баланс зарядов в соединении. Это позволяет металлам образовывать соли, оксиды и гидроксиды, которые являются основными строительными блоками многих химических соединений.
Заряженность ионов металла также влияет на их способность проявлять каталитическую активность. Ионы металла могут играть ключевую роль в химических реакциях, ускоряя их протекание или меняя путь реакции. Например, ионы металла могут донорировать или принимать электроны, что позволяет им активировать молекулы реагентов и образовывать промежуточные соединения.
Важно отметить, что заряженность ионов металла также может влиять на их растворимость в воде и других растворителях. Некоторые ионы металла обладают большей растворимостью, в то время как другие могут быть малорастворимыми и образовывать осадки. Это свойство может быть использовано в различных химических процессах, таких как осаждение нежелательных ионов в водных системах или выпадение осадков для получения чистого вещества.
Какие ионы металла могут иметь различную зарядку

В ионометрии часто можно встретить ионы металла с различными зарядками. Зарядка иона металла зависит от количества электронов, которые он получил или отдал. Обычно ионы металла содержат положительную зарядку, так как они обычно отдают электроны, чтобы достичь стабильной октаэдрической конфигурации.
Некоторые ионы металла могут иметь не только одну, но две или даже несколько различных зарядок. Это связано с возможностью металла отдать разное количество электронов в разных условиях и окружении. Это разнообразие зарядок металла позволяет образовывать различные соединения и химические соединения с другими элементами.
Чтобы указать зарядку иона металла, используют числовые индексы в заголовках. Например, Fe^2+ означает двухвалентный ион железа, который потерял два электрона. В то же время, Fe^3+ означает трехвалентный ион железа, который потерял три электрона. Это примеры ионов металла с различной зарядкой и указывают на возможность металла иметь несколько различных зарядок.
Ионы металла с различными зарядками являются важными для понимания химических реакций и формирования соединений. Они могут образовывать комплексы с другими веществами, влиять на растворимость и стабильность соединений, а также определять их электрохимические свойства. Поэтому изучение и понимание ионов металла с различными зарядками является важной частью химической науки.
Вопрос-ответ

Почему ионы металла всегда заряжены?
Ионы металла всегда заряжены, потому что они образуются путем потери или приобретения электронов. Когда металл теряет электрон(ы), он становится положительно заряженным ионом или катионом. Если металл принимает дополнительные электроны, он становится отрицательно заряженным ионом или анионом. Таким образом, заряд иона металла зависит от того, сколько электронов он потерял или приобрел.
Какие процессы приводят к образованию заряженных ионов металла?
Образование заряженных ионов металла происходит в результате двух основных процессов: потери электронов и приобретения электронов. Когда металл теряет один или несколько электронов, он становится положительно заряженным ионом или катионом. Например, Na (натрий) теряет один электрон и становится Na+ (ион натрия). Обратно, когда металл принимает дополнительные электроны, он становится отрицательно заряженным ионом или анионом. Например, Cl (хлор) принимает один электрон и становится Cl- (ион хлора).
Может ли ион металла иметь разные заряды?
Да, ион металла может иметь разные заряды в зависимости от числа потерянных или приобретенных электронов. Некоторые металлы, такие как железо (Fe), могут иметь ионы с разными зарядами. Например, ион железа Fe2+ имеет заряд +2, а ион Fe3+ имеет заряд +3. Это связано с возможностью металла потерять разное число электронов и образовать ионы с разной зарядностью.
Почему ионы металла имеют положительный заряд?
Ионы металла имеют положительный заряд, потому что они теряют один или несколько электронов при образовании. Внешние электроны металла, находящиеся в его валентной оболочке, слабо связаны и могут быть легко удалены при взаимодействии с другими веществами. Когда металл теряет электроны, он становится положительно заряженным, так как количество положительных протонов в ядре остается неизменным, а количество отрицательных электронов уменьшается.
