Электролитическая диссоциация является одним из основных процессов в химических реакциях, при которых происходит распад веществ на ионы. Такой процесс происходит и в случае металлов, которые при наличии электролита разделяются на ионы положительного и отрицательного заряда.
Образование ионов металла при электролитической диссоциации происходит благодаря воздействию внешнего электрического поля. В электролите присутствуют свободные электроны и металлические катионы, которые перемещаются под влиянием поля. При этом, катионы освобождаются от атомов металла и становятся полностью ионизированными.
Процесс электролитической диссоциации металлов имеет множество практических применений. Например, он используется в технологиях гальванического покрытия, когда на поверхность различных материалов осаждается тонкий слой металла, чтобы быть защищенным от коррозии или придать ему определенные свойства.
Также, электролитическая диссоциация металлов играет важную роль в аккумуляторах, где происходит переход ионов металла на электроды во время зарядки или разрядки. Благодаря этому процессу, аккумуляторы могут накапливать и выделять большое количество энергии, что делает их необходимыми источниками питания во многих областях жизни.
Таким образом, образование ионов металла при электролитической диссоциации является важным явлением в химии и имеет широкое применение в различных технологиях и устройствах.
Принципы электролитической диссоциации металлов
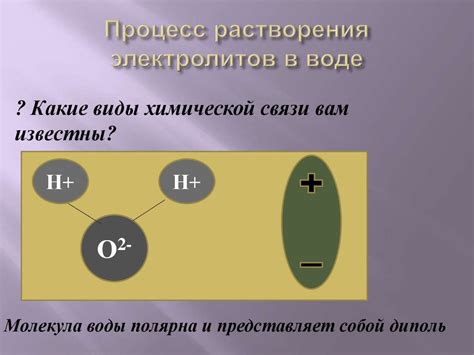
Электролитическая диссоциация металлов основана на принципе разложения металлических соединений на положительно заряженные ионы металла и отрицательно заряженные ионы непосредственно в растворе под воздействием электрического тока. Этот процесс возникает в растворе электролита при проведении электролиза.
Когда электрический ток проходит через раствор электролита, он вызывает перемещение заряженных частиц внутри раствора, тем самым ионизируя металл. При этом положительно заряженные ионы металла (катионы) переносятся к катоду, а отрицательно заряженные ионы (анионы) направляются к аноду.
В процессе электролитической диссоциации металлов важную роль играют концентрация раствора электролита, температура и мощность электрического тока. Обычно, чем выше концентрация раствора, тем больше ионов металла образуется при электролизе. Также, повышение температуры может способствовать увеличению скорости диссоциации металлов и, соответственно, увеличению количества образованных ионов.
Электролитическая диссоциация металлов находит широкое применение в различных областях, включая производство металлов, электрохимические процессы, а также в химическом анализе. Благодаря этому принципу, мы можем получать и использовать различные металлы для разных целей.
Процесс окисления и восстановления металла

Окисление и восстановление металлов - это важные процессы, которые происходят при электролитической диссоциации в растворе. Во время процесса окисления металл теряет электроны, становясь положительно заряженным ионом – катионом. Этот процесс является анодным и осуществляется на поверхности электрода, который и окисляется.
Восстановление металла, наоборот, происходит при получении электродами свободных электронов из внешнего источника. При этом катионы металла поглощают электроны и превращаются в нейтральные металлические атомы, которые осаждаются на поверхности электрода. Восстановление металла происходит на катоде.
Процесс окисления и восстановления металла является важным, так как позволяет использовать электролитическую диссоциацию для различных целей. Например, он используется в процессе гальванизации, при которой на поверхность металлического изделия осаждается другой металл. Также этот процесс используется в электрохимических аккумуляторах, где происходит обратимое окисление и восстановление металлических ионов, что позволяет хранить и выделять энергию.
Важно отметить, что процесс окисления и восстановления металла осуществляется под воздействием электрического тока. При этом, окисление и восстановление происходят одновременно, но вводимым в систему током регулируется скорость различных реакций. Таким образом, электролитическая диссоциация позволяет контролировать процессы окисления и восстановления металла, что находит свое применение в различных сферах нашей жизни.
Ролевая ионная динамика в электролитической диссоциации
Электролитическая диссоциация - процесс, при котором ионы металла образуются в растворе под воздействием электрического тока. Этот процесс имеет важное значение в высокохимической промышленности, так как позволяет получать различные металлы из их соединений.
Ролевая ионная динамика в электролитической диссоциации заключается в разделении ролей ионов металла и ионов растворителя. Ионы металла, называемые катионами, перемещаются к отрицательно заряженной электроде (катоду), где они получают электроны и осаждаются в виде металлического осадка. Ионы растворителя, называемые анионами, перемещаются к положительно заряженной электроде (аноду), где они получают электроны и участвуют в реакциях окисления.
Ионная динамика в процессе электролитической диссоциации зависит от различных факторов, таких как концентрация ионов металла и ионов растворителя, плотность электрического тока, время и температура. Контролируя эти факторы, можно регулировать процесс образования металлического осадка и получать ионы металла нужного качества и чистоты.
Роль ионной динамики в электролитической диссоциации заключается также в обеспечении равномерного и эффективного протекания процесса. Правильное распределение ионов металла и ионов растворителя между электродами позволяет уменьшить потери энергии и повысить производительность процесса. Кроме того, ионная динамика может влиять на качество и свойства получаемого металла, например, на его твердость, структуру и электрохимическую активность.
Таким образом, ролевая ионная динамика играет важную роль в электролитической диссоциации, позволяя управлять образованием ионов металла и получать металлы высокой чистоты и качества. Исследование и оптимизация этого процесса имеют большое значение для развития современных технологий и промышленности.
Взаимодействие металлических и неметаллических ионов
При электролитической диссоциации металлические и неметаллические ионы могут взаимодействовать друг с другом, образуя различные соединения. Такие взаимодействия происходят в электролитах, содержащих соль, и в процессе электролиза.
Металлические ионы, обладающие положительным зарядом, притягивают к себе неметаллические ионы, которые имеют отрицательный заряд. Таким образом, образуются ионные связи между металлом и неметаллом. Это является основой для образования солей, которые представляют собой кристаллические соединения, состоящие из положительных и отрицательных ионов.
Взаимодействие металлических и неметаллических ионов может приводить к образованию различных химических соединений. Например, соединение между металлом натрием и неметаллами кислородом и серой приводит к образованию солей натрия, как, например, натрия хлорида (NaCl), натрия оксида (Na2O), натрия сульфата (Na2SO4) и т.д.
Также возможно взаимодействие металлических и неметаллических ионов в процессе электролиза. При электролизе раствора соли, металлические ионы могут переходить на катод, а неметаллические ионы - на анод. В результате этого процесса образуются отдельные элементы и соединения. Например, при электролизе раствора хлорида натрия (NaCl) на аноде образуются хлор (Cl2), а на катоде - натрий (Na).
Образование положительно заряженных металлических ионов
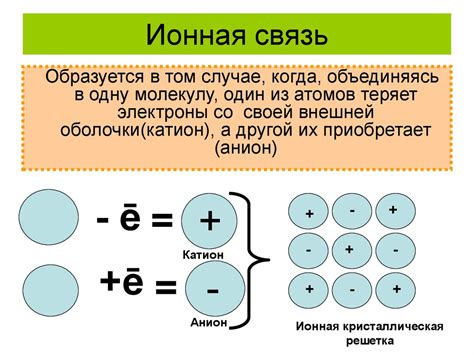
При электролитической диссоциации металлические вещества могут образовывать положительно заряженные металлические ионы. Это происходит в результате воздействия электрического тока на раствор или плавящийся металл.
Положительное заряжение иона обусловлено тем, что в процессе электролиза электроны переносятся от металла к аноду, оставляя вещество положительно заряженными ионами. Таким образом, металлический ион получает дополнительное положительное зарядовое состояние.
Образование положительно заряженных металлических ионов происходит в растворе на катоде или в качестве отложений на аноде при электролизе. Кроме того, положительно заряженные металлические ионы могут также образовываться при плавлении металлов в присутствии электрического тока.
Важно отметить, что образование положительно заряженных металлических ионов является ключевым процессом в электролитической диссоциации и используется в различных областях, включая электрохимические процессы, гальванические элементы и электропокрытие поверхностей металлов.
Деление ионов по силе окислительности
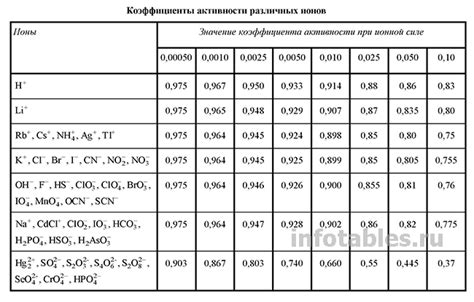
Сила окислительности ионов металла влияет на их способность вступать в химические реакции, включая электролитическую диссоциацию. Окислительная способность ионов металла зависит от их степени окисления и электронной конфигурации. Чем выше степень окисления ионов металла, тем сильнее их окислительная способность.
Деление ионов металлов по силе окислительности позволяет предсказывать характер химических реакций, в которых они могут участвовать. Ионы с более высокой силой окислительности с легкостью окисляют ионы с более низкой силой окислительности в соответствующих химических реакциях.
Чтобы определить силу окислительности ионов металла, можно использовать электрохимический ряд или таблицу стандартных окислительно-восстановительных потенциалов. Этот ряд содержит информацию о том, какие ионы металла способны окислить другие ионы металла при данной температуре и давлении.
На основе электрохимического ряда можно определить периодическую закономерность силы окислительности ионов металла. Ионы металлов в верхней части ряда, такие как ионы алюминия и железа, имеют более высокую силу окислительности и могут окислять ионы, находящиеся ниже в ряду, например, ионы магния и цинка. Ионы металлов в нижней части ряда, такие как ионы натрия и калия, имеют более низкую силу окислительности и могут быть окислены ионами, находящимися выше в ряду.
Электрохимические реакции и образование ионов металла
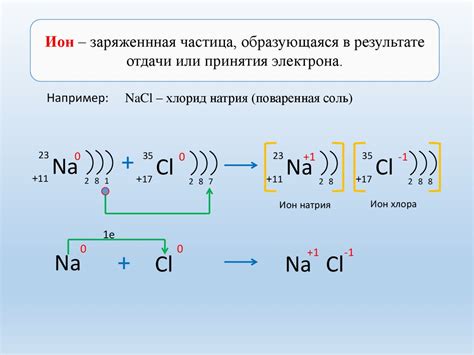
Электрохимические реакции являются основой для понимания образования ионов металла при электролитической диссоциации. В процессе электролиза, когда на электроды подается постоянное напряжение, происходит окисление и восстановление веществ, частным случаем которых являются металлы.
При электролитической диссоциации в растворе электролита металл переходит в ионы и образует однополярные ионные соединения. Позитивно заряженные ионы металла называются катионами, а отрицательно заряженные ионы, образующие соединение с металлом, - анионами.
Электролитическая диссоциация возникает благодаря положительному заряду на электроде, на который переносятся электроны и происходит редокс-реакция. В результате, металл окисляется, теряет свои электроны и превращается в катион. На другом электроде происходит обратная реакция, в результате которой катионы превращаются обратно в металл, восстанавливая свой исходный заряд.
Важно понимать, что образование ионов металла при электролитической диссоциации является фундаментальным процессом, который позволяет осуществлять различные технологические процессы, такие как гальваническое покрытие металлом, электролиз воды для получения водорода и кислорода, а также многие другие применения в промышленности и науке.
Скорость образования ионов при электролитической диссоциации

Скорость образования ионов при электролитической диссоциации является важной характеристикой данного процесса. Она определяет, как быстро ионы металла образуются в растворе при подаче внешнего электрического тока.
Скорость образования ионов зависит от ряда факторов, таких как концентрация электролита, температура раствора и приложенное напряжение. В частности, при увеличении концентрации электролита скорость образования ионов также увеличивается, поскольку больше ионов может реагировать между собой.
Температура также оказывает влияние на скорость образования ионов. При повышении температуры, молекулы раствора приобретают большую кинетическую энергию, что способствует более активным коллизиям между молекулами и ионами металла.
Приложенное напряжение является другим ключевым фактором, влияющим на скорость образования ионов. При достаточно высоком напряжении, больше электронов будет переноситься через раствор и больше ионов будет образовываться.
Скорость образования ионов может быть измерена с использованием различных методов, таких как электрохимические методы и спектроскопия. Эти методы позволяют установить зависимость скорости образования ионов от различных факторов и определить оптимальные условия для эффективной диссоциации металла в растворе.
Вопрос-ответ

Что такое электролитическая диссоциация?
Электролитическая диссоциация - это процесс распада молекул веществ под воздействием электрического тока на ионы.
Как образуются ионы металла при электролитической диссоциации?
При электролитической диссоциации металлического соединения, атомы металла образуют положительно заряженные ионы, которые перемещаются к аноду.
