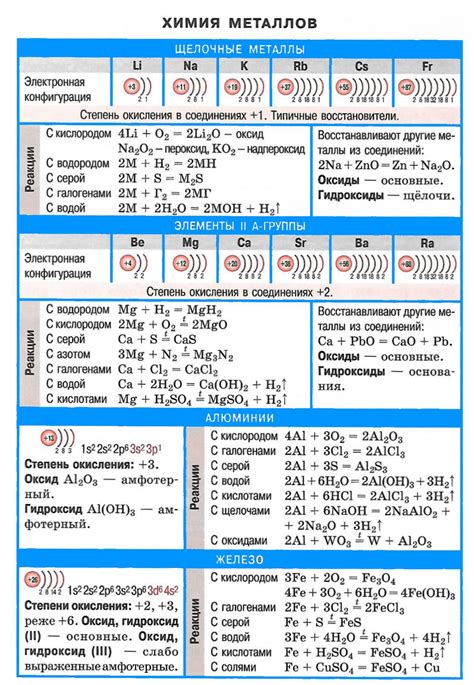
Взаимодействие щелочных металлов с кислородом приводит к образованию оксидов. Оксиды щелочных металлов - это химические соединения, состоящие из металлического и кислородного атомов. Они обладают разнообразными свойствами и широко применяются в различных отраслях научных и технических областей.
Образование оксидов щелочных металлов при взаимодействии с кислородом происходит в соответствии с реакцией окисления. Кроме того, данный процесс сопровождается выделением тепла и образованием электрической энергии. Интенсивность реакции зависит от различных факторов, таких как температура, давление и концентрация реагентов.
Оксиды щелочных металлов имеют различные физические и химические свойства. Например, они обладают высокой термической и электрической проводимостью, а также низкой температурной стабильностью. Некоторые оксиды щелочных металлов являются кислотами или щелочами и проявляют амфотерные свойства. Такие свойства находят применение в различных процессах, таких как производство стекла, электролиз воды и других важных промышленных процессах.
Роль кислорода в образовании оксидов щелочных металлов

Одной из важных ролей кислорода в химических реакциях является его участие в образовании оксидов щелочных металлов. Щелочные металлы, такие как литий, натрий и калий, активно взаимодействуют с кислородом и образуют различные оксиды.
В процессе взаимодействия щелочных металлов с кислородом происходит окисление металла, что приводит к образованию оксида. Этот процесс является экзотермическим и сопровождается выделением тепла.
Оксиды щелочных металлов обладают различными свойствами и широко используются в различных областях. Например, оксиды лития применяются в литий-ионных аккумуляторах, оксиды натрия используются в производстве стекла и мыла, а оксиды калия являются важными компонентами удобрений.
Кроме того, взаимодействие кислорода с щелочными металлами может протекать при высоких температурах и давлениях. В этом случае образуются более сложные соединения, такие как пероксиды и супероксиды.
Таким образом, роль кислорода в образовании оксидов щелочных металлов является неотъемлемой. Этот процесс играет важную роль в химической промышленности и предоставляет широкий спектр материалов с различными свойствами и применениями.
Важность кислорода для реакции щелочных металлов
Взаимодействие щелочных металлов с кислородом является важным процессом, который приводит к образованию оксидов щелочных металлов. Кислород играет решающую роль в этой реакции, так как является необходимым реагентом для образования оксидов.
Кислород предоставляет атомы, которые вступают во взаимодействие с щелочными металлами и образуют их оксиды. Оксиды щелочных металлов, такие как оксид натрия и оксид калия, обладают важными физическими и химическими свойствами и широко используются в промышленности и научных исследованиях.
Реакция щелочных металлов с кислородом происходит при высоких температурах и обычно сопровождается энергичным выделением тепла. Это позволяет использовать данную реакцию для получения энергии в различных технологиях и процессах.
Кроме того, взаимодействие щелочных металлов с кислородом имеет важное значение в биологических системах. Например, кислород является неотъемлемым компонентом для дыхания организмов, включая растения и животных. Кислород ищелочные металлы играют важную роль в поддержании энергетического обмена между клетками и окружающей среды.
Процесс образования оксидов

Образование оксидов щелочных металлов при взаимодействии с кислородом является химической реакцией, происходящей при высоких температурах. В результате этой реакции вещества изменяют свою структуру, преобразуясь в более стабильные соединения. Как правило, оксиды щелочных металлов обладают основными свойствами и образуются при взаимодействии с кислородом из атмосферы.
Процесс образования оксидов щелочных металлов можно разделить на несколько стадий. В начале происходит физическое взаимодействие между металлическим основанием и кислородом. При этом осуществляется активация частиц кислорода, что позволяет им проникнуть в структуру металла. Затем происходит химическая реакция, в результате которой образуются молекулы оксида и выделяется энергия.
Оксиды щелочных металлов имеют высокую устойчивость и обладают специфическими физико-химическими свойствами. Они являются твердыми веществами, обладающими высокой температурной устойчивостью. Кроме того, оксиды щелочных металлов обладают основными свойствами, при взаимодействии с водой они образуют гидроксиды и выделяют большое количество тепла.
Образование оксидов щелочных металлов при взаимодействии с кислородом является важным процессом в химической промышленности. В процессе производства электроэнергии, металлургии и других отраслях используются оксиды щелочных металлов в качестве катализаторов, конденсаторов и других функциональных материалов. Понимание процесса образования оксидов помогает улучшить технологии производства и создать новые материалы с улучшенными свойствами.
Свойства щелочных металлов и их оксидов
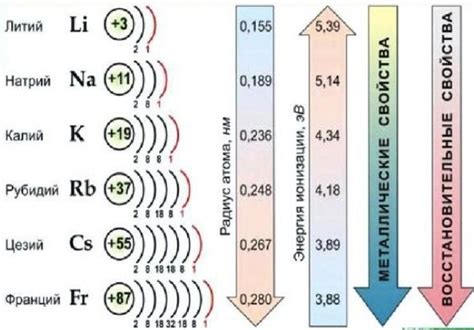
Щелочные металлы представляют собой группу химических элементов, включающую литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой химической реактивностью и активностью. Щелочные металлы являются металлами первой группы периодической таблицы.
Свойства щелочных металлов включают низкую плотность и температуру плавления, высокую электропроводность и хорошую деформационность. Они отличаются мягкостью, легкостью кусания и низкой твердостью. Щелочные металлы реагируют с водой, образуя щелочные растворы. Они также реагируют с кислородом и образуют оксиды.
Оксиды щелочных металлов обладают особыми свойствами. Они являются соединениями сильных оснований и образуют водные растворы, которые обладают щелочными свойствами. Оксиды щелочных металлов обладают высоким показателем щелочности и могут использоваться в процессах нейтрализации кислот. Они также обладают высокой электропроводностью, что делает их полезными в электрохимических процессах.
Оксиды щелочных металлов имеют различные химические формулы и свойства. Например, оксид лития (Li2O) является бесцветным кристаллическим веществом, образующим щелочную среду в водных растворах. Оксид натрия (Na2O) имеет желтоватый цвет и также обладает сильными щелочными свойствами. Оксид калия (K2O) имеет белый цвет и используется в стекольной промышленности для повышения температуры плавления стекла.
Химические свойства щелочных металлов

1. Реакция с водой: Щелочные металлы имеют сильное алкалическое действие, поэтому при их взаимодействии с водой происходит образование гидроксидов соответствующих металлов и выделение водорода. Реакция протекает очень быстро и с большим выделением тепла.
2. Образование оксидов: Щелочные металлы активно реагируют с кислородом, образуя оксиды металлов. Эти оксиды обладают щелочными свойствами и легко растворяются в воде, образуя гидроксиды.
3. Способность к окислению: Щелочные металлы обладают способностью к окислению. Они могут образовывать ионы с положительными зарядами, теряя электроны. Например, калий может образовывать ионы K+.
4. Восстановительные свойства: Щелочные металлы также обладают восстановительными свойствами. Они могут передавать свои электроны другим веществам, окисляясь при этом самостоятельно. Например, натрий может восстановить ионы железа Fe3+ до Fe2+.
5. Образование солей: Щелочные металлы реагируют с кислотами, образуя соли и воду. Эти реакции происходят с выделением теплоты и сопровождаются характерными химическими изменениями.
Физические свойства оксидов щелочных металлов
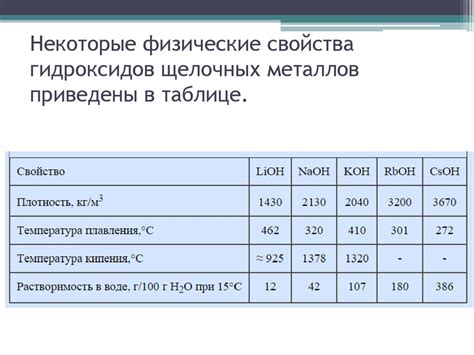
Оксиды щелочных металлов являются соединениями, образованными в результате взаимодействия щелочных металлов с кислородом. Они представляют собой кристаллические вещества, обладающие определенными физическими свойствами.
Одним из характерных свойств оксидов щелочных металлов является их высокая термическая устойчивость. Оксиды щелочных металлов обычно обладают высокими точками плавления и кипения, что связано с их кристаллической структурой и сильными ионными связями.
Кроме того, оксиды щелочных металлов обладают хорошей проводимостью электричества. Это связано с наличием ионов металла в их структуре, которые могут свободно двигаться в кристаллической решетке и обеспечивать электропроводность.
Еще одним характерным свойством оксидов щелочных металлов является их щелочной характер. Они обладают способностью реагировать с кислотами, образуя соли и воду. Это связано с наличием ионов оксида и ионов металла, которые могут реагировать с ионами кислоты, образуя стабильные соединения.
Таким образом, оксиды щелочных металлов обладают определенными физическими свойствами, которые обусловлены их структурой и химическими свойствами. Знание этих свойств позволяет понять и объяснить реакции их взаимодействия с другими соединениями и веществами.
Вопрос-ответ

Какие оксиды образуют щелочные металлы при взаимодействии с кислородом?
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, образуют оксиды соответственно: Li2O, Na2O, K2O, Rb2O и Cs2O.
Какие реакции происходят при образовании оксидов щелочных металлов?
При взаимодействии щелочных металлов с кислородом происходит окисление металла, при котором образуется соответствующий оксид. Например, при реакции натрия с кислородом образуется оксид натрия:
