Ионная химическая связь является одним из видов химической связи, которая образуется между атомами металлов и неметаллов. Основой ионной связи является образование ионов положительного и отрицательного заряда путем передачи или приема электронов. Таким образом, ионная связь возникает из-за различия в электроотрицательности атомов, где атом с большей электроотрицательностью образует отрицательный ион, а атом с меньшей электроотрицательностью - положительный.
Ионная связь характеризуется сильной прочностью, так как положительные и отрицательные ионы притягиваются друг к другу электростатической силой. Более того, в результате образования ионной связи между атомами металлов возникают кристаллические решетки, где положительные ионы располагаются в зарядовых центрах, а отрицательные ионы занимают промежуточные позиции. Это особенность ионной химической связи между атомами металлов, которая обусловлена их особыми физико-химическими свойствами.
Ионная связь играет важную роль во многих химических реакциях и явлениях. Она определяет физические и химические свойства веществ, обладающих ионной структурой. Также ионная связь обладает свойствами проводить электрический ток, что делает ее незаменимой для создания различных электротехнических устройств и материалов. Исследование ионной химической связи имеет большое значение для понимания и развития современной науки и технологии.
Основные принципы ионной химической связи
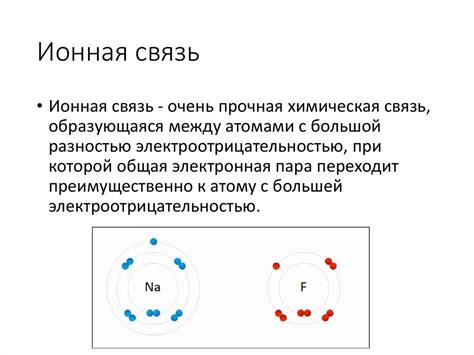
Ионная химическая связь основана на электростатическом притяжении между положительно и отрицательно заряженными ионами. Она возникает между атомами металлов и атомами неметаллов.
Основным принципом образования ионной связи является перенос электронов от металла к неметаллу. Металл отдает один или несколько электронов и превращается в положительно заряженный ион, а неметалл принимает эти электроны и становится отрицательно заряженным ионом.
Заряд иона зависит от числа переданных или принятых электронов. Если металл отдает один электрон, он становится ионом с зарядом +1, если отдает два электрона - заряд +2 и т.д. Неметалл, принимающий электроны, приобретает соответствующий отрицательный заряд.
Образование ионной связи обеспечивает высокую устойчивость ионов в решетке кристаллической решетки. Положительные ионы металла окружаются отрицательными ионами неметалла, и наоборот. Это приводит к образованию кристаллической структуры с определенной геометрией и высокой прочностью связей.
Ионная химическая связь является одной из наиболее распространенных в химии и объясняет свойства многих веществ, таких как соли, минералы и кристаллы.
Важность электроотрицательности

Электроотрицательность является одной из самых важных характеристик атомов в контексте ионной химической связи. Она определяет способность атома притягивать электроны к себе в химической связи. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны, и тем более полярной будет химическая связь, образованная между этим атомом и атомами других элементов.
В ионной связи атомы металлов, имеющие маленькую электроотрицательность, отдают свои валентные электроны атомам неметаллов, имеющим большую электроотрицательность. Это происходит из-за наличия расхождения в электроотрицательности, что ведет к образованию ионов с положительным и отрицательным зарядами.
Как было сказано, электроотрицательность влияет на полярность ионной связи. В случае, если атомы образуют ионную связь с разными значениями электроотрицательности, связь будет полярной. Полярность связи определяется разностью электроотрицательностей атомов, а также их размерами и валентностью. Знание электроотрицательности позволяет прогнозировать образование ионных связей и определять химические свойства соединений.
Образование ионной связи между атомами металлов
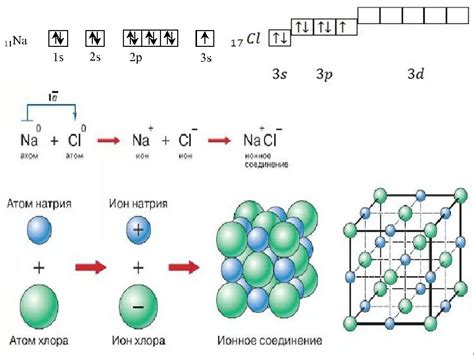
Ионная связь представляет собой тип химической связи, который образуется между атомами металла и неметалла. Однако существует также ионная связь между атомами двух металлов. Образование ионной связи происходит в результате передачи электронов от одного атома к другому.
Для образования ионной связи между атомами металлов важна способность металлов отдавать электроны. Металлы обладают низкими значениями электроотрицательности, поэтому они готовы отдать свои электроны, чтобы образовать позитивно заряженные ионы - катионы.
При образовании ионной связи электроны отданных атомами металла переходят на атомы неметалла, которые становятся отрицательно заряженными ионами - анионами. Таким образом, между атомами металла и неметалла образуется притяжение, которое и называется ионной связью.
Ионная связь между атомами металлов обладает рядом особенностей. Во-первых, она характеризуется высокой прочностью, так как электроны, перешедшие от металла к неметаллу, создают электростатическое притяжение. Во-вторых, ионная связь обусловливает расположение атомов металла и неметалла в определенной решетке, что обеспечивает устойчивость вещества.
Таким образом, образование ионной связи между атомами металлов основывается на способности металлов отдавать электроны и на притяжении между заряженными ионами. Эта связь обладает высокой прочностью и обеспечивает устойчивость соединения металла и неметалла.
Структура ионных кристаллов
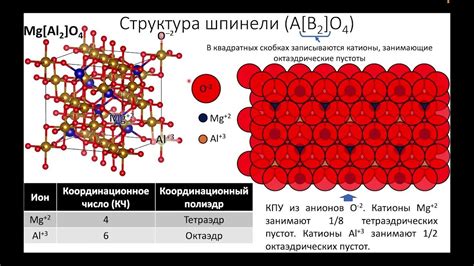
Ионные кристаллы представляют собой кристаллические соединения, в которых катионы и анионы размещаются в определенном порядке, образуя трехмерную регулярную структуру.
Структура ионных кристаллов основана на принципе электрической нейтральности: общий заряд катионов должен быть равен общему заряду анионов. Для этого катионы и анионы объединяются в различные пропорции, образуя равновесную систему.
Кристаллическая решетка ионных кристаллов образуется благодаря взаимной притяжению положительно и отрицательно заряженных ионов. Каждый ион образует пространственно-ориентированные связи с несколькими ионами другого заряда, образуя систему с определенной координацией.
Структура ионных кристаллов может быть представлена в виде трехмерных решеток или сеток, в которых ионы занимают определенные узлы. Между ионами существуют электростатические взаимодействия, которые обеспечивают прочность и устойчивость кристаллической структуры.
Ионные кристаллы обладают характерными физическими свойствами, такими как высокая температура плавления и кипения, твердость, хрупкость и способность проводить электрический ток в растворенном или расплавленном состоянии.
Плотность ионного упаковывания
Ионное упаковывание определяет, как близко ионы располагаются друг к другу в кристаллической решетке. Оно влияет на свойства веществ, включая их плотность, твердость и электрическую проводимость.
При формировании ионной решетки ионы занимают определенное пространство, которое определяет их плотность упаковывания. Эта плотность может быть выражена в виде отношения объема ионов к объему кристаллической решетки или в виде числа ионов, умещающихся в одной ячейке решетки.
В случае ионов металлов, характерных для ионной химической связи, плотность упаковывания очень высока. Ионы металла, образующие решетку, занимают необходимое пространство, которое позволяет им образовывать прочные связи с другими ионами. Это свойство определяет высокую плотность металлов и их способность к поддаваться пластической деформации.
Например, металлы, такие как сталь или алюминий, обладают высокой плотностью упаковывания, что делает их твердыми и прочными. В то же время, у металлов есть возможность поддаваться пластической деформации при воздействии внешней силы, благодаря особенностям их ионного упаковывания.
Вопрос-ответ

Как образуется ионная химическая связь между атомами металлов?
Ионная химическая связь между атомами металлов образуется при переходе электронов с одного атома на другой. Атом, утрачивающий электроны, становится положительно заряженным ионом, а атом, получающий электроны, становится отрицательно заряженным. Образование ионной связи происходит из-за различия в электронных конфигурациях между этими атомами.
Какие особенности имеет образование ионной химической связи между атомами металлов?
При образовании ионной химической связи между атомами металлов, металлы отдают электроны и образуют положительно заряженные ионы, тогда как неметаллы получают эти электроны и образуют отрицательно заряженные ионы. Полученные ионы притягиваются друг к другу электростатической силой, образуя ионную связь. Эта связь обычно является кристаллической структурой, где положительно заряженные ионы размещаются рядом с отрицательно заряженными ионами.
