В химии оксиды являются одним из основных классов неорганических соединений. Среди них особую роль играют оксиды металлов, которые обладают рядом уникальных свойств. Одним из главных факторов, определяющих их химическую активность и структуру, является ионная связь.
Ионная связь возникает между металлическим и неметаллическим элементами в оксидах металлов. Основным принципом такой связи является образование положительно и отрицательно заряженных ионов. Металлический элемент образует положительные ионы, отдавая электроны, а неметаллический элемент образует отрицательные ионы, принимая электроны. Именно электростатическое взаимодействие между этими ионами и образует ионную связь.
Влияние ионной связи на свойства оксидов металлов состоит в формировании их геометрической структуры и твердости. Ионные связи образуют решетки, которые, в зависимости от радиусов ионов и их зарядов, могут быть компактными или пространственными. Компактные решетки характеризуются высокой плотностью и прочностью материала, тогда как пространственные решетки обладают большой пористостью и механической гибкостью.
Ионная связь оксидов металлов играет ключевую роль в создании различных функциональных материалов, таких как керамика, катализаторы и полупроводники. Именно благодаря своим уникальным свойствам, оксиды металлов находят широкое применение в промышленности и технологиях разных областей.
Определение ионной связи
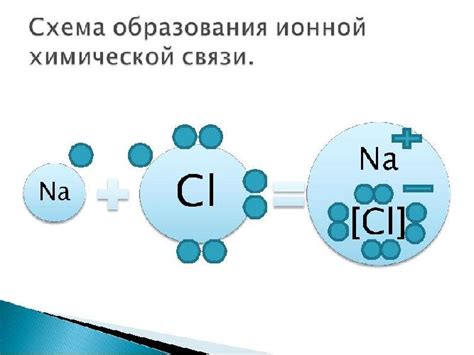
Ионная связь является одной из основных форм химической связи, которая возникает между атомами вещества. Характерной особенностью ионной связи является образование ионов, положительно и отрицательно заряженных частиц. Ионы могут быть положительными, если они потеряли один или несколько электронов, или отрицательными, если они получили дополнительные электроны.
Основой для образования ионной связи является разность электроотрицательности между атомами вещества. Электроотрицательность определяет склонность атома принимать или отдавать электроны. Если электроотрицательность атома сильно превалирует над электроотрицательностью другого атома, то электроны перераспределяются в пользу более электроотрицательного атома, что приводит к образованию ионной связи.
Вещества с ионной связью обычно обладают высокой температурой плавления и кипения, а также хорошей проводимостью электрического тока в расплавленном или растворенном состоянии. Это связано с тем, что ионы могут легко передвигаться веществом, образуя электрический ток.
Ионная связь также оказывает влияние на другие свойства вещества, такие как твердость, растворимость и химическую активность. Вещества с ионной связью часто образуют соли, которые характеризуются соединением металла и неметалла. Примерами веществ с ионной связью являются многие оксиды металлов, которые образуются при реакции металла с кислородом.
Влияние ионной связи на свойства вещества

Ионная связь является одной из основных форм химической связи в оксидах металлов. Эта связь основана на притяжении электрически заряженных ионов, что приводит к возникновению устойчивой кристаллической структуры и определяет множество свойств вещества.
Одной из главных характеристик, определяемых ионной связью, является температура плавления вещества. Оксиды металлов с ионной связью обычно обладают высокими температурами плавления, так как требуется большое количество энергии для разрушения кристаллической решетки и разделения ионов.
Ионная связь также влияет на электропроводность оксидов металлов. Вещества с ионной связью в твёрдом состоянии являются плохими электропроводниками, так как ионы фиксированы в решетке и не могут двигаться. Однако при плавлении или растворении оксидов металлов ионы приобретают свободность и способность проводить электрический ток.
Кроме того, свойства оксидов металлов сильно зависят от заряда ионов и их радиуса. Большой радиус ионов облегчает их движение и приводит к более высокой электропроводности вещества. Также, чем выше заряд ионов, тем более сильная ионная связь и, соответственно, более высокая температура плавления вещества.
Влияние ионной связи на свойства вещества позволяет объяснить множество физических и химических свойств оксидов металлов и является основой для практического применения этих соединений в различных отраслях промышленности и науки.
Основные принципы образования ионной связи

Ионная связь - это тип химической связи, который образуется между ионами разноименных зарядов. Она характеризуется передачей электронов от одного атома к другому, что приводит к образованию положительно и отрицательно заряженных ионов.
Основным принципом образования ионной связи является достижение электронной конфигурации инертного газа. Атомы металлов, имеющие мало электронов во внешней оболочке, стремятся отдать эти электроны и образовать положительно заряженные ионы - катионы. Атомы неметаллов, имеющие большое количество электронов во внешней оболочке, стремятся принять электроны и образовать отрицательно заряженные ионы - анионы. Таким образом, ионная связь возникает из-за разности электронных потенциалов атомов металла и неметалла.
Степень ионизации атомов зависит от их расположения в периодической системе. Атомы металлов, находящиеся слева от периодической системы, легко отдают электроны и образуют положительно заряженные ионы малого размера. Неметаллы, находящиеся справа от периодической системы, с большими радиусами иэлектронами во внешней оболочке, легко принимают электроны и образуют отрицательно заряженные ионы большого размера. Это объясняет, почему ионная связь наиболее типична для соединений между металлами и неметаллами.
Объемные свойства ионных соединений также связаны с образованием ионной связи. Ионы в ионной решетке образуют лежащие рядом сферы, что ведет к кристаллической структуре вещества. Кристаллические решетки ионных соединений обладают высокой твердостью, точками плавления и кипения, так как силы, действующие между ионами, являются кулоновскими силами притяжения, которые требуют большой энергии для нарушения связи.
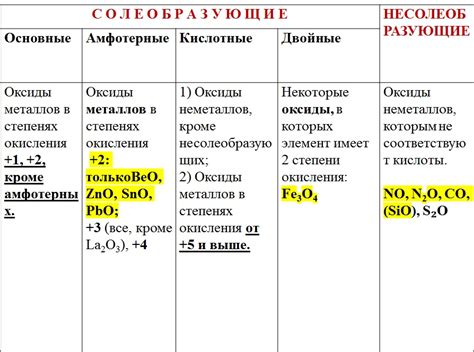
Типы оксидов металлов
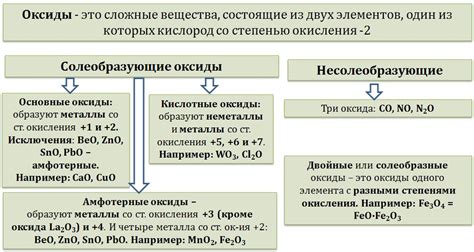
Оксиды металлов — это соединения, состоящие из атома металла и одного или нескольких атомов кислорода. В зависимости от степени окисления металла и его электроотрицательности, оксиды металлов могут быть различных типов.
Квасиметаллические оксиды образуются при взаимодействии двух металлов с высокими электроотрицательностями. Такие соединения обладают характерными свойствами, такими как пониженная электропроводность и высокая температура плавления.
Переходные оксиды образуются при окислении переходных металлов. Они обладают разнообразными свойствами, включая цветность, магнитные свойства и каталитическую активность. Некоторые переходные оксиды используются в промышленности в качестве катализаторов или пигментов.
Щелочные оксиды получаются при реакции щелочных металлов с кислородом. Они обладают высокой щелочной активностью и химической реактивностью, способствуя образованию оснований и гидроксидов при растворении в воде.
Щелочноземельные оксиды образуются при взаимодействии щелочноземельных металлов с кислородом. Они имеют более высокую электроотрицательность по сравнению с щелочными оксидами и проявляют большую степень алкальности при растворении в воде.
Амфотерные оксиды обладают способностью взаимодействовать с кислотами и основаниями. Эти оксиды могут проявлять кислотные или щелочные свойства в зависимости от условий реакции.
Химические свойства оксидов металлов
Оксиды металлов, главным образом, характеризуются ионной связью, что определяет их основные химические свойства. Ионная связь возникает между металлическим и не металлическим элементами, приводя к образованию ионов металла и кислорода. Оксиды металлов обладают высокой твердостью и температурой плавления, что связано с межатомными взаимодействиями ионов в кристаллической решетке.
Оксиды металлов растворяются в воде, демонстрируя реакцию с образованием основания. Например, оксид натрия реагирует с водой, образуя гидроксид натрия:
- Na2O + H2O → 2NaOH
При взаимодействии оксидов металлов с кислотами происходят реакции окисления-восстановления. Кислота отдает протон (H+), а металлический оксид при этом подходит к кислороду кислоты. Например, оксид железа (III) реагирует с соляной кислотой:
- Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Оксиды металлов проявляют способность к окислению других соединений и веществ. Это объясняется высоким электроотрицательностью кислородного атома и его способностью принимать электроны, что приводит к образованию ионов кислорода с отрицательным зарядом.
Некоторые оксиды металлов обладают каталитической активностью. Они способны активировать поверхностные реакции, ускоряя химические процессы. Катализатором часто служит оксид металла в наноразмерном состоянии, имеющий большую площадь поверхности.
Таким образом, химические свойства оксидов металлов определяются их структурой, ионной связью и электрохимическими свойствами ионов металла и кислорода.
Физические свойства оксидов металлов

Оксиды металлов, образующиеся в результате реакции металлов с кислородом, обладают рядом характерных физических свойств.
Во-первых, оксиды металлов обычно хорошо проводят электричество. Это связано с наличием ионов металла, которые свободно перемещаются внутри решетки оксида и способны переносить заряд.
Во-вторых, многие оксиды металлов обладают высокой степенью твердости. Это связано с ионной связью, которая обеспечивает прочную и устойчивую структуру решетки оксида.
Кроме того, оксиды металлов обычно обладают высоким плавлением и кипением. Например, некоторые оксиды, такие как оксид железа Fe2O3, имеют высокую температуру плавления, что делает их полезными в процессе обжига керамики.
Также стоит отметить, что оксиды металлов могут обладать оптическими свойствами. Некоторые из них способны поглощать или отражать определенные длины волн света, что придает им цвет. Например, оксид меди Cu2O имеет красный цвет, а оксид железа FeO – зеленый.
В общем, физические свойства оксидов металлов определяются их структурой и химическим составом, что делает их важными и интересными объектами исследования для многих научных и технических областей.
Вопрос-ответ

Что такое ионная связь оксидов металлов?
Ионная связь оксидов металлов - это связь, которая образуется между положительно заряженными ионами металла и отрицательно заряженными ионами кислорода в оксиде. Это один из видов химической связи, где происходит передача электронов между атомами, в результате чего образуются ионы с противоположным зарядом и их притяжение.
Какие принципы лежат в основе ионной связи оксидов металлов?
Ионная связь оксидов металлов основана на том, что кислород, как электроотрицательный элемент, электростатически притягивает электрооположенные металлические ионы. При этом, металлические ионы отдают свои электроны кислороду, образуя положительные ионы. Кислород же, получив электроны, образует отрицательный ион. Таким образом, образуются заряженные частицы - ионы, которые притягиваются друг к другу и формируют кристаллическую структуру вещества.
