Ионная связь – это один из видов химической связи, которая образуется между атомами или молекулами, когда они обмениваются электронами. В результате такого обмена образуются ионы – атомы или молекулы с положительным или отрицательным электрическим зарядом. Ионная связь является одной из основных форм связи в неорганической химии и играет важную роль во многих физико-химических процессах.
Металлы, характеризующиеся высокой проводимостью электрического тока и тепла, являются типичными формами веществ с ионной связью. Такие металлы, как натрий, калий, магний, алюминий и железо, имеют общую черту – внешний электронный слой, полностью заполненный электронами. Это позволяет им легко отдавать электроны в процессе образования ионов положительного заряда.
Периодическая система элементов является отличной моделью для объяснения ионной связи. Типичные элементы, способные образовывать ионы, находятся в определенных участках таблицы элементов. Например, металлы находятся слева и по середине таблицы, в то время как неметаллы находятся справа.
Среди неметаллов, способных образовывать ионы отрицательного заряда, можно выделить хлор, фтор, серу и кислород. Они имеют высокую электроотрицательность и стремятся принять дополнительные электроны, чтобы достичь электронной октиети (заполненность внешнего электронного слоя). Такие процессы образуют ионы отрицательного заряда.
Ионная связь: основные черты и свойства

Ионная связь - это тип химической связи, которая образуется между атомами металла и неметалла. В результате ионной связи образуются ионы, которые притягиваются друг к другу на основе электростатического притяжения.
Ионы, участвующие в ионной связи, обладают положительным и отрицательным зарядами. Металл отдает один или несколько электронов, становясь положительно заряженным ионом (катионом), а неметалл принимает эти электроны, приобретая отрицательный заряд и становясь отрицательно заряженным ионом (анионом).
Ионная связь обладает несколькими характерными чертами и свойствами. Первое свойство - это великая сила притяжения между ионами, что обеспечивает высокую температуру плавления и кипения ионных соединений. Это объясняется тем, что для разрыва ионной связи требуется значительное количество энергии.
Кроме того, ионные соединения обладают кристаллической структурой, что связано с упорядоченным расположением ионов в решетке. Такая структура придает ионным соединениям определенные механические свойства, такие как твердость и хрупкость.
Ионная связь также обладает свойством электропроводности в расплавленном или растворенном состоянии. Поскольку ионы могут перемещаться, связанные электроны могут передаваться от одного иона к другому, что обеспечивает проводимость электрического тока.
Важно отметить, что ионная связь является одним из основных типов связей в химии и образует множество веществ, включая соли, оксиды и гидроксиды. Ионные соединения широко используются в различных областях, включая металлургию, электротехнику и медицину.
Что такое ионная связь?
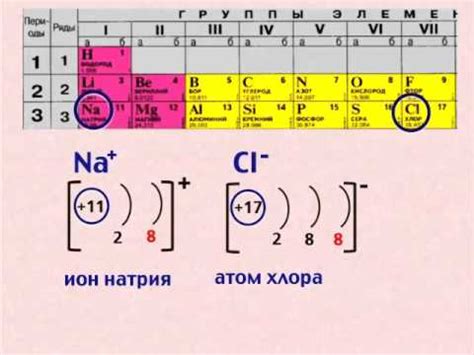
Ионная связь — это силовая связь между атомом, образующим положительный ион (катион) и атомом, образующим отрицательный ион (анион). В ионной связи электроны передаются от одного атома к другому, создавая электрическое притяжение между ионами.
Чтобы произошла ионная связь, один из этих атомов должен иметь большую электроотрицательность, приводя к образованию положительного или отрицательного иона. Металлы обычно образуют положительные ионы, тогда как неметаллы образуют отрицательные ионы.
Катионы и анионы образуют кристаллическую решетку в ионной соединении, где каждый ион окружен противоположно заряженными ионами. Эта решетка обеспечивает стабильность и прочность соединения. Ионная связь обладает высокой кристаллической структурой и обычно имеет высокую температуру плавления и кипения.
Ионная связь важна для понимания различных химических реакций и свойств веществ. Она играет ключевую роль в образовании солей, окислительно-восстановительных реакциях и многих других процессах в химии и материаловедении.
Примеры типичных металлов
Металлы – это элементы, которые обладают отличными проводящими свойствами и могут образовывать ионные связи. В таблице Менделеева большинство элементов в левой части отделено штриховой вертикальной линией. Эти элементы называются типичными металлами.
Железо: один из наиболее распространенных металлов в земной коре. Оно имеет серую окраску и высокую плотность. Обладает высокой прочностью и магнитными свойствами. Железо используется для производства стали и других металлических сплавов.
Медь: мягкий и пластичный металл с красноватым оттенком. Хорошо проводит электричество и тепло. Медные сплавы широко используются в электротехнике, строительстве и производстве монет.
Алюминий: легкий и прочный металл серебристого цвета. Обладает хорошей коррозионной стойкостью и низкой плотностью. Алюминий находит применение в авиационной и автомобильной промышленности, производстве упаковочных материалов и строительстве.
Свинец: мягкий и пластичный металл, имеющий сине-серый цвет. Хорошо согревается и используется для пайки и защиты от радиации. Также свинец используется для производства аккумуляторов и патронов.
Цинк: благородный металл с серебристо-белым цветом. Обладает высокой коррозионной стойкостью и используется для оцинкования. Также цинк применяют при производстве литейного сплава и в батарейной промышленности.
Это лишь некоторые примеры типичных металлов, которые широко распространены и имеют множество применений в различных отраслях промышленности и науки.
Примеры элементов в ионной связи
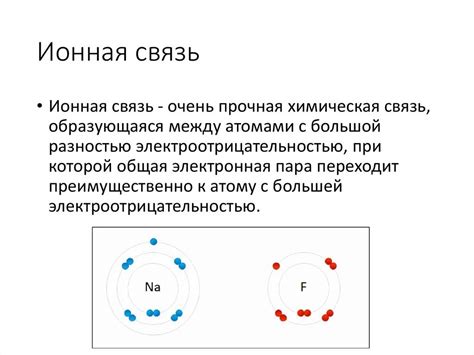
Ионная связь является одним из основных типов химических связей и проявляется во многих химических соединениях. Она возникает между положительно и отрицательно заряженными ионами и основана на их электростатическом притяжении. Примерами элементов, образующих ионную связь, являются:
- Натрий (Na) – металл, который образует положительно заряженный ион Na+, отдавая один электрон. Часто встречается в соединениях, таких как хлорид натрия (NaCl) – простейший вид соли.
- Калий (K) – металл, образующий положительно заряженный ион K+, отдавая один электрон. В соединениях, например, с хлором, образуется хлорид калия (KCl).
- Магний (Mg) – металл, образующий положительно заряженный ион Mg2+, отдавая два электрона. Примерами соединений магния являются оксид магния (MgO) и сульфат магния (MgSO4).
- Алюминий (Al) – металл, образующий положительно заряженный ион Al3+, отдавая три электрона. Например, в оксиде алюминия (Al2O3) алюминиевые ионы связываются с ионами кислорода.
Эти элементы, в сочетании с различными атомами других элементов, образуют разнообразные ионные соединения, которые имеют стабильную структуру благодаря сильной электростатической силе между положительно и отрицательно заряженными ионами.
Преимущества и недостатки ионной связи
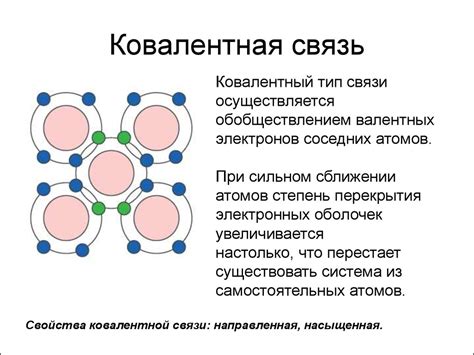
Преимущества:
- Ионная связь обладает высокой прочностью и стабильностью, поэтому соединения с ионной связью обычно обладают высокими температурами плавления и кипения. Это является преимуществом при использовании таких соединений в различных технических и промышленных процессах.
- Ионные соединения обладают свойством электролитичности, то есть способностью проводить электрический заряд, что позволяет использовать их в качестве электролитов в аккумуляторах и электролизерных процессах.
- Ионная связь обеспечивает высокую химическую инертность соединений с ионной связью, что делает их устойчивыми к окислительным и восстановительным процессам.
- Ионные соединения обладают хорошей растворимостью в воде, что позволяет использовать их в различных химических и биологических процессах, включая процессы жизнедеятельности организмов.
Недостатки:
- Образование ионной связи требует значительной энергии, которая освобождается при ее разрушении. Это может вызывать опасность и создавать трудности в обработке и хранении соединений с ионной связью.
- В некоторых случаях ионная связь не обеспечивает достаточную прочность соединения, что может приводить к его разрушению или хрупкости.
- Ионные соединения могут обладать ограниченными многолетними химическими перспективами из-за возможности их деградации и изменения свойств со временем.
- Обильное образование ионных соединений в некоторых процессах может вызывать нежелательные эффекты, такие как образование накипи или загрязнение воды и почвы.
В целом, ионная связь является важным физико-химическим явлением, имеющим свои преимущества и недостатки в различных сферах применения и взаимодействия с окружающей средой.
Вопрос-ответ

Какая важность ионной связи в химии?
Ионная связь является одной из основных форм химической связи. Она играет важную роль в образовании соединений и взаимодействии различных элементов и соединений. Ионная связь обуславливает множество физических и химических свойств веществ.
Какие элементы образуют ионные связи?
В ионных связях обычно участвуют металлы и неметаллы. Металлы отдают электроны и образуют положительно заряженные ионы (катионы), а неметаллы принимают электроны и образуют отрицательно заряженные ионы (анионы).
Каковы типичные металлы, образующие ионные связи?
Типичные металлы, образующие ионные связи, включают щелочные металлы (например, литий, натрий, калий), щелочноземельные металлы (например, магний, кальций, барий), а также металлы из группы переходных металлов (например, железо, медь, цинк).
Какие элементы образуют ионные связи с металлами?
Неметаллы, такие как кислород, сера, хлор, а также положительные радикалы, такие как гидроксид, карбонат, нитрат и другие, образуют ионные связи с металлами.
