Ионная связь - это тип химической связи, который возникает между атомами металла и неметалла в соединениях. Основой ионной связи является притяжение противоположно заряженных ионов друг к другу.
Атомы металлов, таких как натрий или калий, имеют тенденцию отдавать свои электроны, становясь положительно заряженными ионами, или катионами. Атомы неметаллов, например, хлор или кислород, имеют тенденцию принимать эти электроны, становясь отрицательно заряженными ионами, или анионами. Притяжение между катионами и анионами обусловливает образование ионной связи.
Ионная связь обладает высокой энергией связи и обычно приводит к образованию кристаллических структур, таких как соль или минералы. Ионные соединения обычно образуются при реакции между металлами и неметаллами, и могут обладать различными свойствами, в зависимости от ионов, участвующих в связи.
Ионная связь играет важную роль во многих биологических процессах, таких как передача нервных импульсов или сжатие и растяжение мышц. Также ионные соединения широко используются в промышленности, в производстве удобрений, стекла и других веществ. Кроме того, изучение ионной связи важно для понимания физических и химических свойств различных материалов и процессов.
В заключение, ионная связь представляет собой сильное притяжение между ионами металлов и неметаллов, и является основой образования ионных соединений. Она играет важную роль в различных областях, начиная от биологии и заканчивая промышленностью, и является предметом изучения для понимания свойств материалов и процессов.
Что такое ионная связь и как она работает?

Ионная связь - это тип химической связи, который происходит между положительно и отрицательно заряженными ионами. Ионы могут быть образованы при потере или приобретении электронов.
Ионная связь возникает, когда положительно заряженные ионы притягиваются к отрицательно заряженным ионам. Эта сила притяжения определяется электростатическим взаимодействием между зарядами. Чаще всего ионная связь возникает между металлическими и неметаллическими элементами.
В ионной связи атомы металлов, склонные терять электроны, образуют положительно заряженные ионы (катионы), а атомы неметаллов, склонные принимать электроны, образуют отрицательно заряженные ионы (анионы). При образовании ионной связи катионы и анионы притягиваются друг к другу, образуя устойчивую структуру решетки, называемую ионным кристаллом.
Ионная связь обладает высокой степенью прочности и жесткости. Она обуславливает множество особенностей и свойств ионных соединений, таких, как высокая температура плавления и кипения, хорошая электропроводность в расплавленном или растворенном состоянии, хрупкость и твердость ионных кристаллов.
Суть ионной связи в металлах

Ионная связь – это тип химической связи, который образуется между ионами металлов и анионами неметаллов. В отличие от ковалентной связи, где электроны общаются между атомами, ионная связь основывается на притяжении одного заряда к другому.
В металлах ионная связь играет особую роль и является одной из основных причин их уникальных свойств. В металлической решетке положительно заряженные ионы металлов окружены облаком электронов, которые свободно движутся между ионами. Это позволяет металлам быть отличными проводниками электричества и тепла.
Прочность металлов также связана с ионной связью. Вследствие притяжения между ионами и электронами, металлы обладают высокой твердостью и стойкостью к разрушению. Это позволяет им быть использованными во множестве промышленных и конструкционных приложений.
Кроме того, ионная связь в металлах является основой для образования специфических свойств, таких как плавление и кристаллическая структура. Вследствие слабости ионной связи, металлы имеют низкую температуру плавления и образуют характерные кристаллические решетки.
Механизм формирования ионной связи
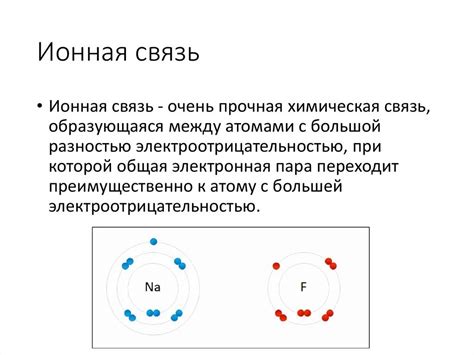
Ионная связь представляет собой тип химической связи, основанный на электростатическом притяжении между ионами с противоположным зарядом. Формирование ионной связи происходит на основе процесса передачи электронов от одного атома к другому.
Ионная связь образуется между металлическим и неметаллическим атомами. В основе механизма этой связи лежит процесс ионизации, при котором атом отдает или получает электроны, образуя положительно или отрицательно заряженные ионы.
Металлы, обладающие низкой электроотрицательностью, имеют тенденцию отдавать электроны, образуя положительно заряженные катионы. Неметаллы, наоборот, с высокой электроотрицательностью имеют тенденцию получать электроны, образуя отрицательно заряженные анионы.
Образовавшиеся ионы с противоположными зарядами притягиваются друг к другу и образуют кристаллическую решетку, состоящую из положительных и отрицательных ионов. Этот процесс обеспечивает стабильность ионной связи и является основой механизма ее образования.
Понятие ионов и их роль в ионной связи
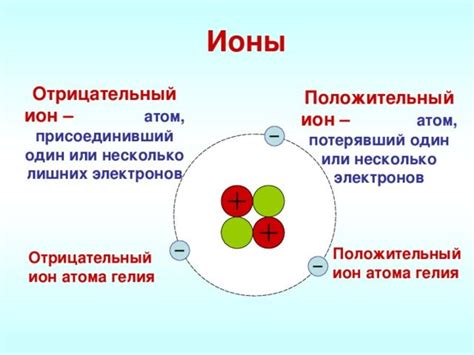
Ионы - это заряженные атомы или молекулы, которые образуются путем потери или приобретения одного или нескольких электронов. Заряд иона может быть положительным (катионом), если атом потерял электроны, или отрицательным (анионом), если атом приобрел дополнительные электроны.
Роль ионов в ионной связи заключается в их привлечении друг к другу на основе электростатических сил. При наличии разницы в зарядах между ионами, положительный ион притягивает отрицательный ион и наоборот. Эта сила притяжения называется ионной связью.
Ионная связь имеет принципиальное значение для образования кристаллических структур в солевых соединениях. В ионной связи атомы образуют устойчивые структуры, при которых ионы формируют трехмерную решетку. Расположение ионов в решетке определяется взаимной силой притяжения и отталкивания между ними.
В ионной связи сильность связи зависит от заряда и размера ионов. Чем больше заряд иона и меньше его размер, тем сильнее ионная связь. Ионная связь также зависит от растояния между ионами и их аэлктического окружения. Чем меньше растояние и чем больше число окружающих ионов, тем сильнее ионная связь.
Ионы в металлах и их электрический заряд
Металлы — вещества, обладающие способностью образовывать ионы, которые являются основными участниками ионной связи. Они образуются в результате потери или приобретения электронов. Металлы обычно обладают наружной оболочкой с недостатком электронов, что позволяет им становиться положительно заряженными ионами, или катионами.
Заряд ионов металлов определяется числом электронов, которые они потеряли. Например, ион натрия Na+ образуется из натриевого атома, потерявшего один электрон. Таким образом, ион натрия имеет положительный заряд +1.
Другой пример — ион железа Fe2+. Он образуется из атома железа, потерявшего два электрона. Поэтому ион железа имеет положительный заряд +2. Как видно из этих примеров, заряд иона металла соответствует числу потерянных электронов. Чем больше электронов потеряли атомы металла, тем больше положительный заряд иона.
Электрический заряд ионов металлов играет ключевую роль в формировании ионной связи. Ионы металлов с положительным зарядом притягивают к себе ионы отрицательного заряда, такие как ионы неметаллов. В результате образуется кристаллическая структура металла, где положительные ионы располагаются в регулярном порядке и образуют решетку. Эта решетка окружает отрицательные ионы, что обеспечивает устойчивость и прочность металла.
Ионы в металлах и их электрический заряд имеют ключевое значение для понимания ионной связи и свойств металлов в целом. Потеря или приобретение электронов металлами позволяет им образовывать устойчивые соединения и характерные структуры, которые влияют на их физические и химические свойства.
Роль ионов в образовании ионной связи
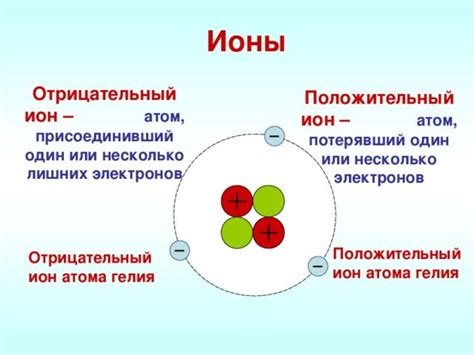
Ионы играют центральную роль в образовании ионной связи, являясь основными строительными блоками этого типа химической связи. Ионы - это заряженные атомы или молекулы, обладающие недостатком или избытком одного или нескольких электронов.
В процессе образования ионной связи, один атом отдает один или несколько электронов, становясь положительным ионом (катионом), а другой атом получает эти электроны, превращаясь в отрицательный ион (анион). Таким образом, ионы притягиваются к друг другу в результате электростатических сил притяжения, образуя кристаллическую структуру.
Катионы и анионы в ионной связи играют разные роли и обладают разными свойствами:
- Катионы, с положительным зарядом, являются источником электронов и имеют тенденцию отдавать их другим атомам. Катионы металлов, такие как натрий или калий, обычно образуются путем потери одного электрона.
- Анионы, с отрицательным зарядом, принимают электроны от других атомов и имеют тенденцию вступать в соприкосновение с катионами. Анионы неметаллов, такие как кислород или хлор, обычно образуются при получении одного или нескольких электронов.
Ионная связь обладает рядом характерных свойств, таких как высокая степень твердости и хрупкости, высокая температура плавления и кипения, а также способность проводить электрический ток в расплавленном или растворенном состоянии.
Физические свойства ионных соединений металлов
Ионные соединения металлов обладают рядом особых физических свойств, которые определяют их химическую и физическую природу.
Первое из таких свойств – высокая температура плавления ионных соединений металлов. Это вызвано тем, что ионные соединения образуются путем притяжения положительно и отрицательно заряженных ионов, что требует большого количества энергии для разрушения связей и расплавления вещества.
Второе важное свойство – электропроводность ионных соединений металлов в расплавленном состоянии или в растворе. Это связано с наличием свободно передвигающихся ионов, способных проводить электрический ток. Благодаря этому, ионные соединения металлов широко применяются в электротехнике и электрохимии.
Третье свойство – твёрдость ионных соединений металлов. Они обладают кристаллической структурой, что делает их твердыми и хрупкими. Данное свойство определяется регулярным расположением ионов в кристаллической решетке.
Расщепление ионных соединений металлов на положительные и отрицательные ионы при растворении в воде – ещё одно физическое свойство. Процесс диссоциации позволяет ионным соединениям образовывать ионо-молекулярные растворы и разделяться на свои составные части.
Таким образом, физические свойства ионных соединений металлов определяются их химической структурой, обусловленной взаимодействием положительно и отрицательно заряженных ионов. Они выражаются в высокой температуре плавления, электропроводности, твёрдости и расщеплении в растворы. Эти свойства делают ионные соединения металлов важными веществами в различных областях науки и техники.
Высокая температура плавления ионных соединений
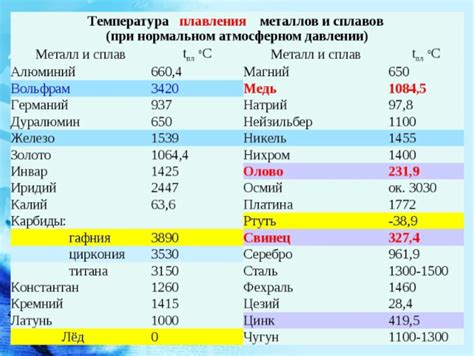
Ионные соединения отличаются высокой температурой плавления по сравнению с молекулярными и атомарными веществами. Это связано с особенностями ионной связи, которая образуется между ионами металлов и неметаллов.
В ионной связи электроны переходят от металла к неметаллу, образуя положительные и отрицательные ионы. Именно эта сила притяжения между ионами ионного соединения обеспечивает его структуру и свойства.
Получившаяся кристаллическая структура в ионных соединениях обладает высокой устойчивостью и требует большого количества энергии для разрушения связей. Вот почему ионные соединения имеют высокую температуру плавления.
Связь в ионных соединениях достаточно крепка, поскольку ионы располагаются в решетке и не перемещаются в пространстве. Это также влияет на высокую температуру плавления, которая необходима для разрушения структуры и освобождения ионов.
Таким образом, высокая температура плавления ионных соединений связана с силой ионной связи и устойчивостью кристаллической структуры. Именно благодаря этим особенностям ионные соединения часто используются в качестве тугоплавких материалов и важных компонентов в различных промышленных процессах.
Вопрос-ответ

Что такое ионная связь?
Ионная связь это тип химической связи, в которой происходит передача электронов между атомами и образование положительно и отрицательно заряженных ионов. Эти ионы притягиваются друг к другу силой электростатического притяжения, образуя кристаллическую решетку или сеть ионов.
Какие частицы участвуют в ионной связи?
В ионной связи участвуют ионы – положительно и отрицательно заряженные частицы. Обычно это ионы металлов и неметаллов. Металлы отдают электроны, становясь положительно заряженными ионами, а неметаллы принимают эти электроны, становясь отрицательно заряженными ионами.
Как происходит образование ионов в ионной связи?
Образование ионов в ионной связи происходит за счет передачи электронов между атомами металла и неметалла. Металл отдаёт электроны из внешней энергетической оболочки, образуя положительно заряженный ион, а неметалл принимает эти электроны, образуя отрицательно заряженный ион. Например, натрий отдаёт электрон, становясь ионом Na+, а хлор принимает этот электрон, становясь ионом Cl-.
В чем заключается особенность ионной связи?
Особенностью ионной связи является сильное притяжение между положительно и отрицательно заряженными ионами. Это притяжение происходит за счет силы электростатического притяжения между зарядами разного знака. Именно благодаря сильному притяжению ионы образуют устойчивую кристаллическую решетку.
