Ионная связь – это электрическое взаимодействие между атомами металлов и неметаллов, основанное на обмене электронами. Это один из основных типов химической связи и играет важную роль во многих процессах и реакциях, происходящих в природе и промышленности.
Принцип ионной связи основан на дисбалансе в количестве протонов и электронов в атомах металлов и неметаллов. Металлы имеют отрицательный заряд, так как в их валентной оболочке находится большое количество свободных электронов. Неметаллы, напротив, имеют положительный заряд, поскольку они обладают недостатком электронов в своей валентной оболочке.
В процессе ионного связывания, между металлами и неметаллами происходит передача электронов. Атом неметалла, нуждающийся в электронах, принимает их от атома металла, которому они представляются сверх избыточными. В результате электронный донор (металл) становится катионом, а электронный акцептор (неметалл) – анионом. Сформировавшиеся ионы притягиваются друг к другу электростатическими силами притяжения и образуют ионную связь.
Ионные связи имеют множество важных свойств и применений. Они обладают высокой прочностью и точкой плавления, что делает их незаменимыми для создания кристаллических соединений, таких как соли. Ионная связь также имеет большое значение в биологических системах, где она отвечает за структуру биологических молекул, включая ДНК, РНК, белки и мембраны клеток.
Ионная связь

Ионная связь - это тип химической связи, проявляющийся во взаимодействии между атомами или ионами разных зарядов.
В основе ионной связи лежит перенос электронов от одного атома к другому. Атомы, отдающие электроны, становятся положительно заряженными ионами (катионами), тогда как атомы, получающие электроны, превращаются в отрицательно заряженные ионы (анионы).
Принцип ионной связи основан на притяжении противоположно заряженных ионов. Наиболее распространенным примером ионной связи является связь между металлом и неметаллом.
В ионной связи металлы обычно отдают один или несколько электронов, образуя положительно заряженные ионы. Неметаллы, в свою очередь, принимают эти электроны и становятся отрицательно заряженными ионами. Затем положительно и отрицательно заряженные ионы притягиваются друг к другу силой кулоновского притяжения, что приводит к образованию кристаллической решетки.
Ионная связь обладает рядом характерных особенностей, таких как высокая температура плавления и кипения ионных соединений, хорошая проводимость электрического тока в растворах и расплавах ионных веществ, и их способность образовывать хрупкие кристаллические структуры. Ионная связь широко применяется в химии, физике и других областях науки и техники.
Влияние зарядов
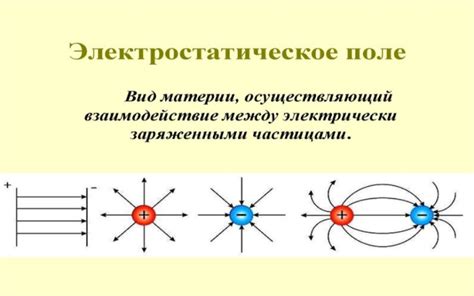
Заряды ионов играют важную роль в ионной связи между металлами и неметаллами. Для образования ионной связи необходимо, чтобы один элемент отдал электроны и стал положительно заряженным ионом, а другой элемент принял электроны и стал отрицательно заряженным ионом. При этом, важно, чтобы заряды ионов были равны по величине и противоположны по знаку, чтобы обеспечить электростатическое притяжение между ними.
Взаимодействие между ионами с разными зарядами приводит к образованию кристаллической решетки, где положительно и отрицательно заряженные ионы расположены в определенном порядке. Эта решетка обеспечивает прочность ионного соединения и его устойчивость.
Заряды ионов также определяют физические и химические свойства ионных соединений. Например, чем больше заряд иона, тем сильнее электростатическое притяжение между ионами, что делает соединение более устойчивым. Кроме того, заряды ионов влияют на растворимость соединения в воде и его электропроводность.
Влияние зарядов также проявляется в реакциях ионных соединений. Заряды ионов определяют химическую активность соединений и их способность проводить различные реакции. Например, положительно заряженные ионы могут вступать в реакции с отрицательно заряженными ионами, образуя новые соединения.
Образование ионов

Ион - это заряженная частица, образующаяся в результате потери или получения одного или нескольких электронов атомом. Образование ионов является основным процессом, который лежит в основе ионной связи.
Металлы образуют положительные ионы путем потери своих внешних электронов. В процессе ионизации металл отдает электроны и превращается в положительный ион. Количество потерянных электронов определяет его зарядность.
Неметаллы, напротив, получают электроны и образуют отрицательные ионы. При ионизации неметалл принимает электроны и превращается в отрицательный ион. Количество полученных электронов также определяет его зарядность.
Ионы притягиваются друг к другу в процессе ионной связи. Положительные ионы металлов становятся окружены отрицательными ионами неметаллов, образуя кристаллическую решетку и ионную соединение. Эта электростатическая сила притяжения между ионами является основой для формирования структуры и свойств ионных соединений.
Примеры взаимодействия между металлами и неметаллами

Ионная связь – это тип химической связи, образующийся между металлами и неметаллами путем обмена электронами. Примерами взаимодействия между металлами и неметаллами являются образование солей, окисление и восстановление, а также процессы гальванических элементов.
Соль – это кристаллическое соединение, состоящее из ионов металла и неметалла, связанных ионной связью. Например, хлорид натрия (NaCl) образуется при взаимодействии ионов натрия (Na+) и ионов хлора (Cl-). При этом, ион натрия отдает один электрон атому хлора, образуя положительно заряженный ион натрия (Na+) и отрицательно заряженный ион хлора (Cl-).
Окисление и восстановление – это реакции, при которых металл отдает или получает электроны. Например, при окислении железа (Fe) образуется ион железа Fe3+, который отдает 3 электрона. Эти электроны принимает ион кислорода (O2-), образуя молекулу кислорода (О2). При восстановлении ион Fe3+ получает 3 электрона и образуется металлическое железо.
Гальванический элемент – это устройство, в котором происходит прямое превращение химической энергии в электрическую энергию. Примером гальванического элемента является батарейка. Внутри батарейки происходит окисление одного из металлов и восстановление другого металла. В результате этого процесса, происходит выделение электронов, которые могут быть использованы для приведения в действие устройства.
Ионная связь между металлами и неметаллами является основой для многих химических реакций и процессов и обуславливает свойства многих веществ. Понимание принципов взаимодействия между металлами и неметаллами имеет большое значение для различных областей науки и техники, включая химию, физику и материаловедение.
Вопрос-ответ

Какие элементы образуют ионные связи?
Ионные связи образуются между металлами и неметаллами. Металлы отдают электроны и образуют положительно заряженные ионы, неметаллы принимают электроны и образуют отрицательно заряженные ионы.
Какие принципы взаимодействия лежат в основе ионных связей?
Основные принципы взаимодействия в ионных связях - это принцип электронной нейтральности (сумма зарядов положительных и отрицательных ионов должна быть равной нулю) и принцип энергетической выгодности (образование ионной связи приводит к снижению энергии системы).
