Ионная связь является одной из основных форм химической связи, которая возникает между ионами разных зарядов. В типичных металлах ионная связь играет важную роль в образовании и поддержании их структуры и свойств.
В металлах основными иональными компонентами являются катионы металла и электроны. Катионы представляют собой положительно заряженные ионы металла, которые образуют регулярную и трехмерную кристаллическую решетку. За счет ионной связи катионы металла удерживаются в решетке, при этом окружающие их отрицательно заряженные электроны создают электрическое поле, обеспечивающее сцепление металлической решетки.
Образование ионной связи в металлах имеет принципиальное значение для их физических и химических свойств. Именно благодаря ионной связи металлы обладают высокой электропроводностью и теплопроводностью, а также способностью образовывать пластичные и неслоевые кристаллические структуры.
Ионная связь в типичных металлах, таких как железо, алюминий, медь и другие, не только обеспечивает их стабильность и прочность, но и определяет их множество физических и химических свойств, которые делают металлы одними из самых важных материалов в промышленности и строительстве.
Сущность ионной связи в металлах

Ионная связь, являющаяся одной из основных типичных связей в металлах, основана на взаимодействии положительно заряженных металлических ионов с отрицательно заряженными электронами. Это связь, которая обеспечивает прочность и устойчивость металлической решетки, характеризующуюся высокой теплопроводностью и электропроводностью.
Суть ионной связи заключается в том, что в металлической решетке положительные ионы металла находятся в регулярной упорядоченной структуре, образуя кристаллическую решетку. В то же время, наличие свободных электронов, образующих электронное облако, обеспечивает металлам способность проводить электрический ток и тепло.
В результате ионной связи металл получает устойчивую структуру и внутреннюю прочность. При воздействии на металл внешних факторов, например, наложения давления или изменения температуры, ионы металла остаются в решетке, сохраняя свою связь с электронами. Это позволяет металлу обладать высокой устойчивостью к внешним воздействиям и объясняет его прочность и твердость.
Таким образом, сущность ионной связи в металлах заключается во взаимодействии положительно заряженных ионов металла с отрицательно заряженными электронами, формирующими электронное облако вокруг ионной решетки. Это обеспечивает металлам их характерные свойства, такие как теплопроводность, электропроводность, прочность и твердость.
Определение ионной связи
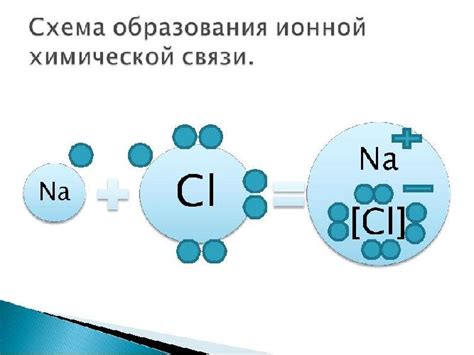
Ионная связь – это тип химической связи, который возникает между атомами металла и атомами неметалла при обмене электронами. В ионной связи происходит передача электронов от одного атома к другому, что приводит к образованию ионов с противоположными зарядами. Положительные ионы, образовавшиеся от атомов металла, называются катионами, а отрицательные ионы, образовавшиеся от атомов неметалла, называются анионами.
Основные характеристики ионной связи:
- Образование ионов с положительными и отрицательными зарядами;
- Притяжение между ионами с противоположными зарядами;
- Высокая электроотрицательность атомов неметалла, что приводит к электронному переносу от металла к неметаллу;
- Образование кристаллической структуры при сближении ионов в решетке;
- Образование непроводящих веществ в твердом состоянии и проводящих веществ в расплавленном или растворенном состоянии.
Ионная связь является важным фактором в химических реакциях и определяет многие свойства типичных металлов, таких как их теплопроводность, электропроводность и пластичность. Также ионная связь играет важную роль в образовании кристаллической структуры металлов и влияет на их физические и химические свойства.
Химические свойства ионных соединений
1. Растворимость
Ионные соединения, как правило, легко растворяются в воде и других полярных растворителях. Это объясняется тем, что полярности молекул воды и ионного соединения позволяет им взаимодействовать. Это же явление позволяет растворять ионные соединения в других веществах.
2. Проводимость электрического тока
Ионные соединения в расплавленном состоянии или в растворе обладают высокой электропроводностью. Влияние на это оказывает наличие свободно движущихся ионов, которые образуют замкнутую цепь и позволяют проводить электрический ток.
3. Способность к окислению и восстановлению
Ионные соединения могут вступать в окислительно-восстановительные реакции, при которых они либо отдают, либо принимают электроны. Этим обуславливается их роль в различных химических процессах, в том числе и в электрохимических системах.
4. Кислотно-щелочные свойства
Многие ионные соединения могут действовать как кислоты или щелочи. Взаимодействие ионов с водой приводит к образованию кислотного или щелочного раствора в зависимости от свойств ионов.
5. Образование кристаллической структуры
Ионные соединения образуют кристаллические структуры, которые обладают определенной регулярностью и пространственной упорядоченностью. Их кристаллическая структура определяет многие физические и химические свойства ионных соединений.
Примеры типичных металлов
Металлы являются одной из наиболее распространенных групп веществ в мире. Они обладают рядом характеристик, таких как высокая тепло- и электропроводность, гибкость и прочность.
Давайте рассмотрим несколько примеров типичных металлов:
Железо - это один из самых распространенных металлов на Земле. Оно используется в производстве различных материалов, например, сталей, чугуна и сплавов. Железо также играет важную роль в организме человека, так как является частью гемоглобина, который обеспечивает перенос кислорода в крови.
Алюминий - это легкий и прочный металл, который широко используется в индустрии. Он применяется для производства авиационных компонентов, автомобильных деталей, упаковочных материалов и многого другого. Кроме того, алюминий используется в строительстве и химической промышленности.
Медь - это мягкий и очень хороший проводник электричества и тепла. Она широко используется в электронике, электротехнике, строительстве и других отраслях. Медные сплавы также используются для производства монет, ювелирных изделий и музыкальных инструментов.
Это только небольшая часть типичных металлов. В мире существует множество других металлов, каждый из которых имеет свои уникальные свойства и применения.
Железо

Железо (Fe) - химический элемент из группы переходных металлов с атомным номером 26 в периодической системе. Это мягкий, серый металл, который обладает высокой теплопроводностью и электропроводностью. Железо является одним из самых распространенных и широко используемых металлов в мире.
Ионная связь в железе обусловлена наличием электрически положительно заряженных ионов Fe2+ и Fe3+. В кристаллической решетке металла железа ионы образуют устойчивые структуры, которые обеспечивают его механическую прочность и устойчивость к высоким температурам.
Для использования железа в различных отраслях промышленности, его обычно сплавляют с другими металлами, такими как углерод, хром, никель и др. Это позволяет улучшить его свойства и подстроить под конкретные требования производства, такие как прочность, устойчивость к коррозии и т.д.
Железо также является необходимым микроэлементом для организма человека. Оно является ключевым компонентом в составе гемоглобина, белка красных кровяных клеток, который отвечает за транспорт кислорода по организму. Недостаток железа может привести к развитию анемии и других заболеваний.
Алюминий

Алюминий - химический элемент с атомным номером 13 и символом Al. Это легкий, серебристо-белый металл, принадлежащий к группе IIIA периодической системы. Алюминий обладает высокой тепло- и электропроводностью, а также хорошей коррозионной стойкостью.
Алюминий часто используется в различных областях промышленности и быту. Его легкость и прочность делают его идеальным материалом для авиационной, автомобильной и судостроительной промышленности. Благодаря своей низкой плотности, он помогает снизить вес конструкций и, соответственно, экономить топливо.
Алюминиевые сплавы также широко применяются для производства различных упаковочных материалов, например, банок и фольги. Благодаря своей устойчивости к коррозии, алюминий можно встретить во многих домашних предметах, таких как кухонные принадлежности, оконные рамы и мебель.
- Важная характеристика алюминия - его способность к оксидации. При контакте с воздухом на его поверхности образуется пассивная оксидная пленка, которая защищает металл от дальнейшей коррозии.
- Алюминий также часто используется в электротехнике. Он является отличным проводником электричества и применяется в кабелях, проводах и различных электронных устройствах.
- Кроме промышленности, алюминий имеет медицинские применения. Он используется для изготовления стентов, протезов и других медицинских изделий благодаря своей биосовместимости.
Таким образом, алюминий является важным и универсальным металлом, который находит применение во многих областях нашей жизни благодаря своим уникальным свойствам и характеристикам.
Медь

Медь - химический элемент с атомным номер 29 и символом Cu. Она является мягким и пластичным металлом с высокой электропроводностью и теплопроводностью. Медь имеет ярко оранжево-красную окраску и блестящую поверхность.
Ионная связь в металлах, в том числе и в меди, проявляется в ионном решетчатом строении. Атомы меди сформированные в кристаллической решетке, периодически упорядочены и соединены электростатическими силами притяжения. Они образуют плоские слои, которые легко сдвигаются друг относительно друга. Именно благодаря этому свойству медь обладает высокой пластичностью и способностью проводить электричество и тепло.
Медь является активным элементом, и в природе чаще встречается в виде руд, прежде всего в виде сульфидов, оксидов и карбонатов. Для того чтобы использовать медь в промышленности, ее сначала надо получить из руды. Это делается в химических процессах, таких, как плавление, электролиз и экстракция.
Медь широко используется в различных областях человеческой жизни, включая электротехнику, строительство, медицину и производство ювелирных изделий. Она также является важным микроэлементом для организма человека, участвуя в различных жизненно важных процессах.
Вопрос-ответ

Каким образом образуется ионная связь в типичных металлах?
В типичных металлах ионная связь образуется в результате взаимодействия положительно заряженных ионов металла с общими электронами, которые образуют «электронное облако». Это приводит к образованию кристаллической решетки, в которой положительные ионы расположены в регулярном порядке, а общие электроны свободно перемещаются между ионами.
Какие свойства типичных металлов связаны с ионной связью?
Ионная связь в типичных металлах обуславливает их характерные свойства. Например, металлы обладают высокой теплопроводностью и электропроводностью, так как общие электроны свободно передают тепловую и электрическую энергию. Ионная связь также придает металлам хорошую пластичность и проволочность, что позволяет им легко деформироваться без разрушения.
Как ионная связь влияет на точку плавления типичных металлов?
Ионная связь существенно влияет на точку плавления типичных металлов. В связи с прочными ионными связями, металлы имеют высокую температуру плавления. Ионное взаимодействие между положительно заряженными ионами и отрицательно заряженными общими электронами требует большой энергии для разрушения и, следовательно, высокой температуры для плавления.
