Ионная связь - это один из видов химической связи, который формируется при взаимодействии атомов неметалла и активных металлов. В ионной связи происходит передача электронов от одного атома к другому, в результате чего образуются положительно и отрицательно заряженные ионы.
Атом неметалла, имеющий высокую электроотрицательность, притягивает электроны к себе сильнее, чем атом активного металла с низкой электроотрицательностью. В результате этого процесса атомы неметалла обретают отрицательный заряд, становятся анионами, а атомы активного металла - положительный заряд, становятся катионами.
Взаимодействие анионов и катионов приводит к образованию кристаллической структуры, где анионы и катионы образуют решетку. Силы притяжения между ионами очень сильные, что делает ионную связь очень прочной и характерной для соединений неметалла и активного металла.
Соединения, образующиеся при ионной связи, обладают рядом особенностей. Они обычно имеют высокую температуру плавления и кипения, а также хорошую электропроводность в расплавленном или растворенном состоянии. Кроме того, такие соединения обладают кристаллической структурой и характерными физико-химическими свойствами.
Механизм образования ионной связи

Ионная связь представляет собой тип химической связи, который осуществляется между атомами неметалла и активного металла. Её механизм образования заключается в передаче электронов от активного металла к неметаллу.
Активные металлы обладают низкой электроотрицательностью и способны легко отдавать электроны из своего внешнего энергетического уровня. Неметаллы, напротив, имеют высокую электроотрицательность и готовы принимать электроны с внешнего энергетического уровня металла.
В результате передачи электрона образуется ион неметалла с отрицательным зарядом (анион), так как он принимает дополнительный электрон, и ион активного металла с положительным зарядом (катион), так как он отдаёт один или несколько электронов.
Полученные ионы с разными зарядами притягиваются друг к другу силами электростатического притяжения, образуя кристаллическую решётку. Таким образом, механизм образования ионной связи заключается в формировании электростатически привлекательных сил между ионами неметалла и активного металла.
Взаимодействие атомов неметалла и активных металлов
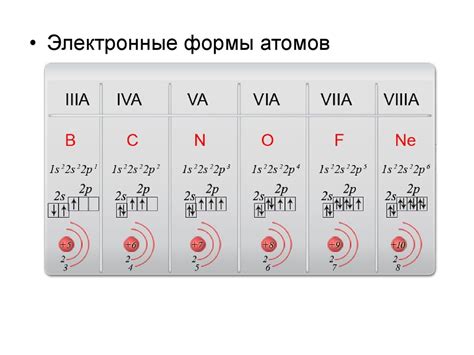
Взаимодействие атомов неметалла и активных металлов ведет к образованию ионной связи, которая является одной из основных форм химической связи. Ионная связь возникает благодаря переносу электронов от металлического атома на неметаллический атом. В результате такого переноса образуются положительно и отрицательно заряженные ионы.
Образование ионной связи происходит благодаря различию в электроотрицательности атомов неметалла и активного металла. Атомы неметалла обладают большей электроотрицательностью и имеют большую аффинность к электронам. Атомы активных металлов, напротив, имеют меньшую электроотрицательность и обладают меньшей аффинностью к электронам. Это позволяет атомам неметалла забрать электроны у атомов металла, образуя отрицательно заряженные ионы неметалла.
Получение положительно заряженных ионов металла происходит за счет отдачи электронов атомами металла. Это обусловлено меньшей аффинностью к электронам у атомов металла. После отдачи электронов атом металла становится положительно заряженным ионом.
Результатом взаимодействия атомов неметалла и активных металлов являются ионные связи, которые обладают высокими прочностными свойствами и характеризуются высокими температурами плавления и кипения, а также хорошей электропроводностью в расплавленном или растворенном состоянии.
Образование положительных и отрицательных ионов

Ионы - это заряженные частицы, образующиеся путем передачи или приобретения электронов. В ионной связи электроны передаются от одного атома к другому, что приводит к образованию положительных и отрицательных ионов.
Положительные ионы, или катионы, образуются в результате потери одного или нескольких электронов атомами металлов. Например, атом натрия (Na) имеет один электрон во внешней электронной оболочке. При взаимодействии с атомом неметалла, таким как хлор (Cl), натрий отдает свой электрон хлору, образуя положительный ион Na+.
Отрицательные ионы, или анионы, образуются в результате приобретения одного или нескольких электронов атомами неметаллов. Например, атом хлора (Cl) имеет семь электронов во внешней электронной оболочке. При взаимодействии с атомом натрия (Na), хлор принимает электрон от натрия, образуя отрицательный ион Cl-.
Образование положительных и отрицательных ионов обеспечивает электрическую нейтральность вещества. В результатах образования ионной связи между атомами неметалла и активных металлов, образованные ионы притягиваются друг к другу электростатическими силами, образуя устойчивую и прочную связь.
Электростатическое притяжение между ионами

Электростатическое притяжение между ионами является одной из основных сил, обуславливающих образование ионной связи между атомами неметаллов и активных металлов. Ионы - это заряженные атомы или молекулы, которые образуются при потере или приобретении электронов. В ионной связи активный металл отдает электроны, становится положительно заряженным ионом (катионом), в то время как неметалл получает эти электроны, становится отрицательно заряженным ионом (анионом).
Ионное связывание сопровождается электростатическим притяжением между положительно заряженными ионами и отрицательно заряженными ионами. Эта сила притяжения основана на принципе, что противоположные заряды притягиваются, а одинаковые заряды отталкиваются. Электростатическое притяжение между ионами имеет очень большую силу, что делает ионную связь очень стойкой и надежной.
Сила электростатического притяжения между ионами зависит от значения ионной зарядности и расстояния между ионами. Чем больше абсолютное значение ионной зарядности, тем сильнее притяжение. Также, чем меньше расстояние между ионами, тем сильнее притяжение. Именно благодаря электростатическому притяжению ионы поддерживаются в кристаллической решетке ионного соединения.
Электростатическое притяжение между ионами также обуславливает характерные свойства ионных соединений. Они имеют высокую температуру плавления и кипения, так как ионные связи не легко разрушить. Ионные соединения образуют кристаллическую структуру, где ионы упорядочены в определенном порядке, что делает их твердыми и легкими. Кроме того, ионные соединения проявляют свойства электролитов, то есть они способны проводить электрический ток в растворах и расплавах.
Устойчивость ионной связи

Устойчивость ионной связи является одним из ключевых показателей химической связи между атомами неметалла и активных металлов. Эта связь возникает при переносе электронов от активного металла к неметаллу, образуя положительные и отрицательные ионы.
Устойчивость ионной связи зависит от таких факторов, как энергия ионизации, электроотрицательность и размеры атомов. Чем больше энергия ионизации активного металла и электроотрицательность неметалла, тем выше будет устойчивость ионной связи.
Также важным фактором является размер атомов. Если размеры атомов сопрягаемых элементов существенно различаются, то ионная связь будет менее устойчивой. Это связано с тем, что большие различия в размерах атомов приводят к значительному искривлению электронных облаков, что снижает устойчивость связи.
Важно отметить, что устойчивость ионной связи может быть ослаблена воздействием внешних факторов, таких как изменение температуры или растворение вещества. При повышении температуры ионная связь может разрушиться из-за теплового движения частиц. А при растворении вещества ионная связь разбивается в результате взаимодействия со средой.
Интересно, что в отличие от ковалентной связи, ионная связь не обладает направленностью. Это означает, что ионы в ионной связи распределены случайным образом, и нет строгого порядка их расположения.
Применение ионной связи в химических реакциях

Ионная связь, являющаяся основой химической связи между атомами неметалла и активных металлов, играет важную роль во многих химических реакциях. Она образуется при передаче электронов от одного атома к другому, создавая положительно и отрицательно заряженные ионы.
Одним из основных применений ионной связи является образование ионных соединений. В этих соединениях атомы неметалла становятся отрицательно заряженными анионами, а активные металлы – положительно заряженными катионами. Примером такого соединения является хлорид натрия (NaCl), где натрий (Na) выступает в роли катиона, а хлор (Cl) – в роли аниона. Ионное соединение обладает высокой стабильностью и часто выступает в качестве соли или минерала.
Ионная связь также играет важную роль в электролитических реакциях. Электролиты – это вещества, которые в растворе или плавленом состоянии разлагаются на ионы и обеспечивают проводимость электрического тока. Электролитические реакции основаны на передаче ионов через раствор или плавленное вещество. Примером такой реакции может быть электролиз воды, где приложение электрического тока приводит к разложению воды на кислородный и водородный ионы.
Кроме того, ионная связь используется в процессе образования сульфатов, карбонатов и других солей, которые активно применяются в различных отраслях промышленности и научных исследованиях. Также ионная связь имеет важное значение в живой природе, поскольку многие биологические процессы, такие как передача нервных импульсов и сжатие мышц, основаны на передвижении ионов через мембраны клеток.
Ионная связь является одной из фундаментальных химических связей и широко используется во многих химических реакциях. Ее понимание и изучение позволяют прогнозировать свойства соединений и разрабатывать новые материалы с определенными характеристиками и свойствами.
Вопрос-ответ

Как образуется ионная связь между атомами неметалла и активных металлов?
Ионная связь между атомами неметалла и активных металлов формируется при передаче одного или нескольких электронов от металлического атома к атому неметалла. В результате образуются ионы с противоположными зарядами, которые притягиваются друг к другу и создают стабильную связь.
Почему ионная связь возникает между атомами неметалла и активных металлов?
Ионная связь между атомами неметалла и активных металлов возникает из-за различия в электроотрицательности этих элементов. Активные металлы имеют низкую электроотрицательность, поэтому они готовы отдать свои электроны неметаллам, имеющим высокую электроотрицательность. Это приводит к образованию положительных и отрицательных ионов, которые притягиваются друг к другу и образуют стабильную связь.
Какие факторы влияют на образование ионной связи между атомами неметалла и активных металлов?
Образование ионной связи между атомами неметалла и активных металлов зависит от нескольких факторов. Важными факторами являются электроотрицательность элементов, размеры ионов, их заряды, а также конкретные условия, в которых происходит реакция. Чем больше разница в электроотрицательности между элементами, тем сильнее будет ионная связь.
Какую роль играют электроны в образовании ионной связи между атомами неметалла и активных металлов?
Электроны играют ключевую роль в образовании ионной связи между атомами неметалла и активных металлов. Прикладываясь к металлическому атому, электроны создают положительный ион, тогда как неметалл принимает эти электроны и становится отрицательным ионом. Эти противоположные ионы притягиваются друг к другу и образуют стабильную ионную связь.
