Ион аммония – один из самых распространенных ионов в органической химии. В прошлом его называли аммониевым катионом и считали, что он является металлом. Однако, современные исследования развеяли этот миф и доказали, что ион аммония на самом деле не является металлом.
Ион аммония состоит из одного атома азота и четырех атомов водорода. Он образуется при диссоциации аммиака в воде. Благодаря своей положительной заряде, ион аммония обладает высокой реактивностью и является важным компонентом в ряде химических реакций.
Необходимо отметить, что металлы обладают такими характеристиками, как блеск, хорошая теплопроводность и электропроводность, а также способность образовывать ионы положительной заряды. Ион аммония не обладает данными свойствами, поэтому его нельзя отнести к металлам.
Важно различать ион аммония и металлы, так как они имеют разные химические свойства и играют разные роли в химических процессах.
Таким образом, ион аммония не является металлом, в отличие от ряда других ионов. Он имеет свои специфические свойства и применяется в различных областях, таких как медицина, сельское хозяйство и производство химических препаратов.
Факты об ионе аммония, которые стоит знать

Ион аммония - это бесцветное и аммиачное вещество, состоящее из азота и водорода. Он широко применяется в различных областях науки и промышленности.
Молекулярная формула иона аммония - NH4+. Он образуется в результате протекания реакции между аммиаком (NH3) и протонами (H+).
Ион аммония хорошо растворяется в воде и служит основой для гидроксидов аммония. Это свойство делает его отличным ингредиентом для бытовых и производственных продуктов, таких как моющие средства и удобрения.
Ион аммония обладает хорошей электропроводностью, что делает его важным компонентом при производстве батарей и аккумуляторов.
Однако несмотря на широкое применение иона аммония, стоит помнить о его токсичности. Внимание следует обращать на правила безопасности при работе с ним, особенно в промышленном производстве.
Ионы аммония также могут быть использованы в медицине, например, в качестве антибактериального средства для лечения инфекций мочевыводящих путей.
Химические свойства иона аммония
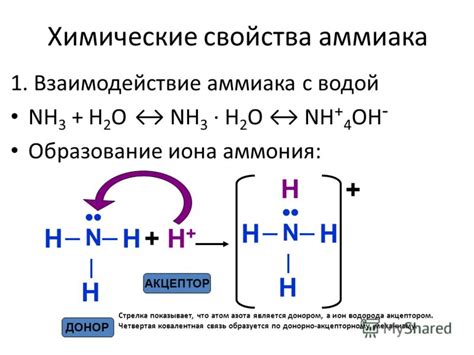
Ион аммония (NH4+) является положительно заряженным ионом, который образуется в результате протонирования аммиака. Он является одним из наиболее распространенных ионов в биологических и агрохимических системах.
Химические свойства иона аммония включают его способность образовывать соли, комплексы и соединения с другими химическими веществами. Он может образовывать соли с различными анинами, такими как нитраты, сульфаты и хлориды. Эти соли применяются в качестве удобрений, а также в производстве различных химических продуктов и лекарственных препаратов.
Ион аммония также обладает амфотерными свойствами, что означает, что он может реагировать как с кислотами, так и с основаниями. Например, он может образовывать ионы аммония с кислотами и образовывать основания сильными кислотами, такими как серная кислота.
Кроме того, ион аммония образует комплексы с различными хелатирующими агентами и может участвовать в различных химических реакциях, таких как обмен ионами и экстракция. Он также может образовывать смеси с другими ионами, что дает ему возможность обладать различными физическими и химическими свойствами в различных средах и условиях.
Способы получения иона аммония
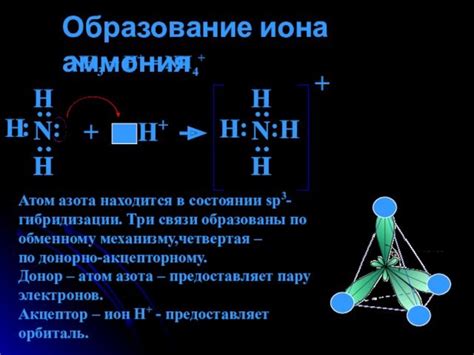
Ион аммония (NH4+) является одним из наиболее распространенных катионов в природе. Он может быть получен различными способами.
1. Гидратация аммиака: аммиак реагирует с водой в присутствии кислоты или щелочи, образуя ион аммония. Эта реакция происходит при комнатной температуре и дает стабильный ионообразный аммиак, который может быть использован в различных промышленных процессах.
2. Реакция нитратов: ион аммония может быть получен путем реакции нитратов с металлами, такими как медь, цинк или железо. Например, при взаимодействии нитрата меди с аммиаком образуется нитрат аммония и осаждается медь.
3. Гидролиз азотной кислоты: азотная кислота может быть гидролизована с помощью щелочи или металлов, таких как магний или цинк. В результате реакции образуется ион аммония и соли металла.
4. Азотистая аммиачная селитра: синтез иона аммония производят путем реакции азотной кислоты с аммиаком. Этот метод широко применяется в промышленности для производства азотной аммиачной селитры, которая является важным удобрением и источником иона аммония.
Таким образом, получение иона аммония возможно различными способами, включая гидратацию аммиака, реакцию нитратов, гидролиз азотной кислоты и синтез азотистой аммиачной селитры. Ион аммония широко используется в различных промышленных и сельскохозяйственных процессах, благодаря своим полезным свойствам и простоте получения.
Применение иона аммония в различных отраслях
Ион аммония является одним из наиболее важных химических соединений и широко применяется в различных отраслях промышленности и науки.
В первую очередь ион аммония используется в химической промышленности для производства удобрений. Он является основным компонентом аммиачной селитры, которая является одним из наиболее распространенных удобрений в мировом сельском хозяйстве.
Ион аммония также широко используется в производстве чистящих средств и дезинфицирующих средств. Благодаря своим антимикробным свойствам, он эффективно уничтожает бактерии и вирусы, делая его идеальным компонентом для средств гигиены и стерилизации.
Не менее важное применение иона аммония находит в производстве бумаги и картонных изделий. Он является частью процесса клеевания иonами аммония, которые обеспечивают прочность и устойчивость бумажных изделий.
Кроме того, ион аммония нашел свое применение в фармацевтической и косметической промышленности. Он используется в составе лекарственных препаратов, а также в качестве компонента в шампунях, гелях для душа и других средствах гигиены.
Безопасность использования иона аммония
Ион аммония является безопасным и широко используемым веществом в различных областях промышленности, научных и медицинских целях. Его использование обусловлено его антимикробными свойствами, что делает его эффективным для борьбы с различными бактериями и вирусами.
Однако, при использовании иона аммония необходимо соблюдать определенные меры предосторожности. При контакте с кожей следует немедленно промыть поверхность водой и, при необходимости, нанести дезинфицирующее средство. В случае попадания в глаза, необходимо промыть их большим количеством проточной воды и обратиться к врачу.
При использовании иона аммония в закрытых помещениях необходимо соблюдать правила хорошей вентиляции, чтобы предотвратить накопление вредных паров. Также следует избегать попадания вещества на пищевые продукты и напитки, а в случае его случайного попадания следует немедленно промыть поверхность водой.
Для обеспечения безопасности при работе с ионом аммония рекомендуется использовать специальный защитный костюм, респиратор, защитные очки и перчатки. Также необходимо хранить вещество в надлежащем закрытом контейнере, чтобы предотвратить его распространение и контакт с другими химическими веществами.
Все эти меры позволяют обеспечить безопасность использования иона аммония и минимизировать риски возможного воздействия на здоровье человека и окружающую среду. При соблюдении указанных мер безопасности, ион аммония остается надежным и эффективным инструментом в борьбе со множеством микроорганизмов.
Вопрос-ответ

Что такое ион аммония?
Ион аммония – это положительно заряженная частица, состоящая из одного атома азота и четырех атомов водорода. Он широко используется в промышленности и сельском хозяйстве, например, в качестве удобрений.
В каких областях применяется ион аммония?
Ион аммония находит применение в различных областях. Он используется в качестве удобрений для растений, в производстве пластмасс, бытовой химии, а также в качестве компонента для медицинских препаратов.
Является ли ион аммония металлом?
Нет, ион аммония не является металлом. Он представляет собой положительно заряженную частицу, состоящую из азота и водорода. Металлы обладают другими свойствами и структурой.
Каким образом ион аммония применяется в производстве пластмасс?
Ион аммония используется в производстве пластмасс в качестве катализатора. Он способствует полимеризации молекул, обеспечивая получение прочного и устойчивого к воздействию внешних факторов материала.
