Азотная кислота (HNO3) является одним из наиболее распространенных и важных химических соединений. Она широко используется в различных сферах, таких как производство удобрений, производство взрывчатых веществ, очистка металлов и многие другие. Одним из интересных аспектов азотной кислоты является ее взаимодействие с разными металлами. В этой статье мы рассмотрим особенности этого взаимодействия и его последствия.
При контакте с металлами азотная кислота может проявлять ряд различных химических реакций. Во-первых, она может окислять металлы, что приводит к образованию оксидов металлов. Например, при взаимодействии с железом азотная кислота окисляет его до образования оксида железа (III). Эта реакция может происходить при комнатной температуре, и при этом выделяется обильное количество газообразных продуктов, таких как оксид азота и диоксид азота.
Во-вторых, азотная кислота может растворять металлы, образуя соли азотной кислоты. Например, с медью азотная кислота образует нитрат меди, который представляет собой зеленое кристаллическое вещество. При этом выделяется диоксид азота, который обладает характерным острым запахом.
Наконец, азотная кислота может вызывать коррозию металлов. Длительное воздействие азотной кислоты на металл может привести к разрушению его структуры, образованию коррозионных пятен и т.д. Коррозия металла, вызванная азотной кислотой, может привести к серьезным последствиям, таким как скрытые повреждения, ослабление конструкций и т.д.
Важно отметить, что взаимодействие азотной кислоты с металлами является важной темой для изучения и понимания процессов, происходящих при взаимодействии химических веществ с разными материалами. Понимание этих процессов помогает разрабатывать эффективные методы очистки и защиты металлов, а также предотвращать возможные опасности и аварии.
Взаимодействие HNO3 с разными металлами: особенности
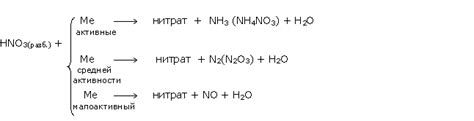
Азотная кислота (HNO3) является одним из наиболее активных окислителей и широко применяется в химической промышленности и лабораториях. Она может реагировать с различными металлами, образуя соли и выделяя обильные количества газообразного оксида азота.
Однако взаимодействие HNO3 с металлами может быть весьма различным в зависимости от их химических свойств. Например, щелочные и щелочноземельные металлы, такие как натрий, калий или магний, реагируют с HNO3 с выделением водорода и образованием соответствующих нитратов. В результате данной реакции образуется растворимая соль и обильно выделяется водородный газ.
С другой стороны, сопротивление HNO3 проявляют некоторые металлы, такие как железо и алюминий. В случае их контакта с азотной кислотой происходит образование пассивной окисной пленки на поверхности металла, которая предотвращает дальнейшее взаимодействие с HNO3.
При взаимодействии HNO3 с некоторыми металлами, такими как ртуть и свинец, могут образовываться ядовитые соли и соединения. Данное взаимодействие может быть опасным и требует особой осторожности при работе с азотной кислотой.
Также стоит отметить, что взаимодействие HNO3 с некоторыми металлами может привести к образованию тяжелорастворимых нитратов или нитритов. При этом происходит образование осадков, что может оказывать негативное влияние на окружающую среду и требует соответствующего утилизации и обработки отходов.
Таким образом, взаимодействие HNO3 с разными металлами имеет свои особенности и последствия, которые важно учитывать при проведении химических реакций и обработке различных материалов. Понимание этих особенностей позволяет эффективно использовать азотную кислоту и избежать возможных негативных последствий.
Окисление и коррозия металлов HNO3

Взаимодействие металлов с концентрированным раствором HNO3 является одним из наиболее распространенных способов окисления и коррозии металлов.
Химическое воздействие HNO3 на металлы основано на окислительных свойствах этого соединения. При контакте с HNO3 металлы подвергаются окислительной реакции, в результате которой образуются оксиды металлов.
Окисление металлов HNO3 обычно сопровождается выделением газов, например, диоксида азота (NO2) или оксида азота (NO), что делает раствор кислоты более активным и коррозивным.
Реакция металлов с HNO3 может быть ускорена, если раствор кислоты нагревается или дополнительно содержит катализаторы, такие как Pt или Pd. В таких условиях окисление металлов происходит более быстро и интенсивно.
Окисление металлов HNO3 может привести к разрушению материала и образованию коррозионных продуктов. Коррозия металлов также может привести к образованию нерастворимых осадков, которые могут заполнить поры и трещины в материале, уменьшая его прочность и стабильность.
Кроме того, окисление металлов HNO3 может быть использовано в различных промышленных процессах для получения оксидов металлов или прочих продуктов, которые имеют большую ценность.
Интенсивность реакции HNO3 с различными металлами
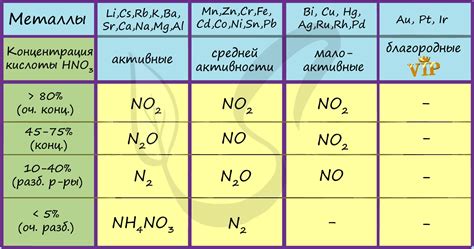
Интенсивность реакции между HNO3 и различными металлами может сильно варьироваться в зависимости от свойств металла. HNO3 является сильным окислителем и способна взаимодействовать с различными металлами, образуя соли и выделяя азотные оксиды.
Самые активные металлы, такие как натрий (Na) и калий (K), реагируют с HNO3 с высокой интенсивностью. При этом образуются азотные оксиды и соответствующие нитраты. Эта реакция сопровождается выделением большого количества тепла и пузырьков газа.
Менее активные металлы, такие как медь (Cu) и железо (Fe), также могут реагировать с HNO3, но реакция протекает медленнее и менее интенсивно. В результате образуются нитрат меди и железа соответственно.
Однако, некоторые металлы, такие как ртуть (Hg) и золото (Au), не реагируют с HNO3 вообще. Это связано с их стабильными химическими свойствами и невосприимчивостью к окислению. В результате таких реакций не образуются нитраты или выделяются только небольшие количества азотных оксидов.
Интенсивность реакции HNO3 с различными металлами может быть важным фактором при выборе материалов для различных химических процессов и экспериментов. Понимание взаимодействия металлов с HNO3 позволяет предсказать возможные реакции и последствия, а также применять эти свойства в различных промышленных и научных областях.
Образование нитратов при взаимодействии HNO3 и металлов

Взаимодействие азотной кислоты (HNO3) с различными металлами является одной из важных химических реакций, приводящих к образованию нитратов. Нитраты являются солью азотной кислоты, содержащей ион NO3-. Этот ион является одним из наиболее распространенных в природе и является важным источником азота для различных процессов и организмов.
В результате взаимодействия HNO3 и металлов происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а азотная кислота восстанавливается. В зависимости от активности металла и концентрации азотной кислоты, реакция может протекать с различной интенсивностью и сопровождаться выделением газов (оксидов азота) и/или образованием осадков (нитратов металла).
Образование нитратов при взаимодействии HNO3 и металлов имеет важные последствия как в химической лаборатории, так и на промышленных объектах. Нитраты металлов могут использоваться в качестве удобрений для растений, а также являться сырьем для производства взрывчатых веществ. Кроме того, неконтролируемое образование нитратов может приводить к загрязнению окружающей среды и нарушению экосистем.
Поэтому важно контролировать и хранить азотную кислоту и металлы с осторожностью, чтобы исключить возможность случайного образования нитратов и минимизировать риски для здоровья и окружающей среды.
Влияние концентрации HNO3 на процесс взаимодействия
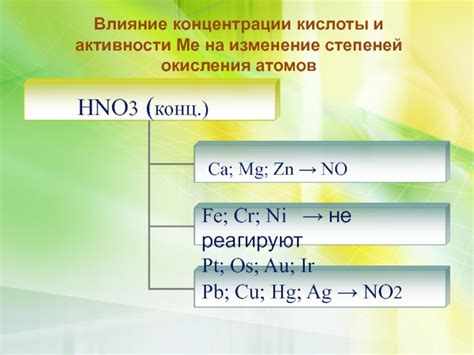
Концентрация HNO3 – один из основных параметров, который определяет характер и интенсивность взаимодействия данной кислоты с металлами. Повышение концентрации HNO3 может привести к более активному процессу окисления металла и увеличению скорости реакции.
Высокая концентрация HNO3 способствует образованию пассивной пленки на поверхности металла, что может существенно замедлить процесс реакции. При этом, если концентрация HNO3 очень высокая, может происходить полное остановление процесса взаимодействия, так как пассивная пленка предотвращает дальнейшее проникновение кислоты.
Оптимальная концентрация HNO3 обычно зависит от конкретного металла и может быть определена экспериментально. Отмечается, что для некоторых металлов, таких как железо или никель, оптимальная концентрация HNO3 составляет около 65-70%.
Следует отметить, что концентрация HNO3 также может влиять на образование продуктов реакции. С повышением концентрации кислоты может увеличиваться количественное содержание оксидов металла в получаемых продуктах.
В целом, влияние концентрации HNO3 на процесс взаимодействия с металлами является сложным и зависит от ряда факторов, таких как металл, температура и длительность воздействия. Тщательное изучение этих зависимостей позволяет оптимизировать процесс и достичь требуемых результатов.
Химические реакции HNO3 с разными группами металлов
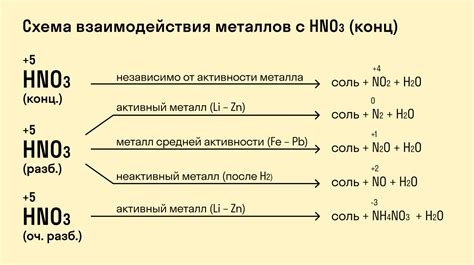
Азотная кислота (HNO3) является одной из самых сильных органических кислот и активно взаимодействует с разными группами металлов. Исходя из их положения в периодической системе, можно сделать общие выводы о реакциях, которые могут происходить.
С щелочными металлами (например, натрием и калием) HNO3 реагирует взрывоопасно с образованием оксида азота и соли этих металлов. Например, такая реакция может быть представлена следующим образом:
2Na + 2HNO3 → 2NaNO3 + H2↑
С щелочноземельными металлами (например, магнием и кальцием) реакция также протекает, но менее интенсивно. В этом случае образуются нитраты, оксид азота и водород. Например:
Mg + 2HNO3 → Mg(NO3)2 + H2↑
С алюминием и другими металлами третьей группы в периодической системе наблюдается пассивация поверхности металла за счет образования оксида, что препятствует дальнейшей реакции с кислотой.
Переходные металлы (такие как железо, медь, никель) взаимодействуют с азотной кислотой с образованием соответствующих нитратов и оксидов металлов. Например, с железными источниками:
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4H2O
Растворимость нитратов металлов в HNO3 связана с их электроным строением и размерами ионов. Металлы с большей растворимостью утворяют более стабильные соединения с более сильным оксидирующим действием азотной кислоты.
Итак, реакции HNO3 с разными группами металлов приводят к образованию нитратов, оксидов и водорода. Важно помнить о том, что эти реакции могут быть опасными, поскольку азотная кислота является агрессивным коррозионным веществом и требует осторожного обращения.
Последствия взаимодействия HNO3 с металлами для окружающей среды

HNO3, или азотная кислота, является одним из промышленно значимых химических соединений. При взаимодействии HNO3 с металлами возникают различные последствия для окружающей среды, которые важно учитывать при проведении химических процессов.
Взаимодействие HNO3 с металлами может приводить к коррозии металлических поверхностей. Азотная кислота обладает высокой коррозионной активностью и способна разрушать металлы, особенно те, которые не обладают достаточной стойкостью к кислотам. При этом происходит выделение вредных газов и соединений, таких как оксиды азота и аммиак, которые отрицательно влияют на состояние атмосферы.
Более того, взаимодействие HNO3 с металлами может приводить к загрязнению почвы и водных ресурсов. Отходы от обработки металлических поверхностей с использованием азотной кислоты могут попадать в почвенный слой и проникать в грунтовые воды, что негативно сказывается на качестве и безопасности питьевой воды. Кроме того, такие загрязнения могут вызывать нарушение экосистемы и вредить растительности и животному миру, связанным с водными и почвенными биотопами.
Для минимизации негативного влияния взаимодействия HNO3 с металлами на окружающую среду необходимо использовать современные методы очистки отходов и обработки сточных вод, а также применять технологии, которые снижают риски коррозии и уменьшают выбросы вредных соединений в атмосферу
Вопрос-ответ

Как взаимодействует HNO3 с разными металлами?
Взаимодействие HNO3 с разными металлами может происходить по разному в зависимости от свойств металла. Некоторые металлы могут реагировать с азотной кислотой, образуя нитраты металлов и освобождаяся оксиды азота. Например, цинк при контакте с HNO3 образует нитрат цинка и оксид азота (II). Железо и алюминий также могут реагировать с азотной кислотой, образуя соответствующие нитраты и оксиды азота.
Какие последствия может иметь взаимодействие HNO3 с металлами?
Взаимодействие HNO3 с металлами может привести к различным последствиям. Во-первых, в результате реакции между HNO3 и металлом могут образовываться нитраты металлов, которые могут быть полезными в различных промышленных процессах. Кроме того, реакция HNO3 с металлами может сопровождаться выделением оксидов азота, которые являются важными компонентами промышленных удобрений и могут использоваться в других промышленных процессах.
Какие металлы могут реагировать с HNO3?
С HNO3 могут реагировать различные металлы, включая цинк, железо, алюминий и многие другие. Взаимодействие металлов с HNO3 зависит от их химических свойств. Например, цинк при контакте с HNO3 образует нитрат цинка и освобождает оксид азота (II). Железо и алюминий также могут реагировать с HNO3, образуя соответствующие нитраты и оксиды азота. Взаимодействие HNO3 с другими металлами может происходить по аналогичным принципам и может приводить к образованию нитратов и оксидов азота.
