В химии оксиды металлов являются одной из основных групп химических соединений. Оксиды металлов представляют собой химические соединения, состоящие из атомов металла и кислорода. Они играют важную роль в различных процессах и имеют широкий спектр применений.
Оксиды металлов могут иметь различные степени окисления, что влияет на их свойства и химическую активность. Один из примеров оксида металла – Hgo. Этот оксид состоит из атомов ртути и кислорода.
Hgo имеет особые свойства и широкий спектр применений. Известно, что ртуть ядовита, однако оксид ртути Hgo является стабильным и относительно безопасным соединением. Он используется в различных отраслях промышленности, а также имеет медицинские применения.
Hgo - широко распространенный оксид металла

Оксид Hgo, также известный как оксид ртути, представляет собой неорганическое соединение, состоящее из атомов ртути и кислорода. Он является одним из наиболее распространенных оксидов металлов и имеет множество применений в различных отраслях.
Hgo обладает высокой химической стабильностью и устойчив к воздействию окружающей среды. Это делает его идеальным материалом для производства электроники, каталитических конвертеров и химических реакторов. Благодаря своим физическим свойствам, оксид Hgo также используется в изготовлении высокоточных приборов и инструментов.
Одним из наиболее известных применений Hgo является его использование в фармацевтической и медицинской промышленности. Оксид ртути широко используется в производстве препаратов и медицинских инструментов благодаря его антимикробным свойствам. Он также применяется для контроля заражения в лабораториях и медицинских учреждениях.
Кроме того, оксид Hgo играет важную роль в производстве стекла. Он добавляется в стеклянные массы для придания им определенных свойств, таких как повышенная прочность и устойчивость к химическому воздействию. Также благодаря Hgo можно получить специальные эффекты на поверхности стекла, такие как зеркальные отражения или изменение цвета.
Таким образом, оксид Hgo является важным и широко применяемым оксидом металла, который находит применение в различных отраслях, начиная от электроники и промышленности, и заканчивая фармацевтикой и производством стекла.
Химические свойства Hgo

Hgo, или оксид ртути, является химическим соединением, содержащим ртуть в форме двуокиси. Он характеризуется своими специфическими химическими свойствами, которые делают его полезным в различных областях науки и техники.
Hgo обладает свойствами кислотного оксида, что означает, что он реагирует с основаниями, образуя соли. Это свойство делает его важным компонентом в производстве различных химических соединений, таких как ртути нитраты и ртути сульфаты, которые используются в медицине, стеклеобработке и электронике.
Кроме того, Hgo обладает амфотерными свойствами, что означает, что он может реагировать как с кислыми, так и с основными веществами. Это позволяет ему использоваться в процессе нейтрализации кислотных и основных реакций, а также в производстве катализаторов.
Hgo также обладает низкой растворимостью в воде, но растворяется в растворителях, таких как кислота и щелочи. Это свойство делает его полезным в процессах очистки воды и снижении загрязнения окружающей среды.
Кроме того, оксид ртути обладает специфическими оптическими свойствами, такими как рентгеновская и ультрафиолетовая прозрачность. Это отличает его от других металлических оксидов и делает его полезным в оптической промышленности и науке.
Физические свойства Hgo

Hgo является оксидом металла, который обладает несколькими характеристиками, определяющими его физические свойства.
Первое из них - густая консистенция. Hgo представляет собой плотную, пастообразную массу, которая легко формируется в различные формы.
Второе - высокая плотность. Hgo обладает плотностью, которая превышает плотность большинства других оксидов металлов. Это говорит о его компактной структуре и массе.
Третье - точка плавления и кипения. Hgo обладает высокой температурой плавления и кипения, что указывает на его стабильность при высоких температурах. Температура плавления и кипения может достигать нескольких сотен градусов Цельсия.
Четвертое - параметры решетки. Атому ртути в оксиде Hgo характерны определенные параметры решетки. Они определяют структуру и связи между атомами в оксиде металла.
Выводя физические свойства Hgo, необходимо учесть, что они определяют его химическое и теплофизическое поведение, что важно при его применении в различных областях науки и промышленности.
Применение Hgo в промышленности

Hgo, жидкий оксид ртути, широко используется в различных отраслях промышленности благодаря своим уникальным свойствам. Его применение связано с его способностью растворяться во многих органических растворителях и реагировать с различными веществами.
Одной из главных областей применения Hgo является производство электроники. Он используется для производства полупроводниковых устройств, таких как транзисторы и интегральные схемы. Hgo обладает высокой стабильностью при высоких температурах, что делает его идеальным материалом для создания элементов электронного оборудования.
Кроме того, Hgo используется в производстве химических веществ. Он служит катализатором для различных химических реакций и используется в процессе синтеза различных соединений. Hgo также используется в процессе сушки и очистки газов, так как способен эффективно удалять различные загрязнения и взаимодействовать с ними.
Также Hgo широко применяется в производстве стекла и зеркал. Он придает стеклу особую прозрачность и глянец, а также повышает его прочность. Hgo также используется для производства зеркал, благодаря своей способности создавать плавный и ровный слой.
В заключение, Hgo, или оксид ртути, является неотъемлемым компонентом в различных отраслях промышленности. Его уникальные свойства делают его незаменимым материалом для производства электроники, химических веществ, стекла и зеркал. Применение Hgo в этих областях способствует развитию современных технологий и улучшению качества продукции.
Влияние Hgo на окружающую среду

Hgo, или ртутный пар, представляет собой оксид металла ртути. Этот вещество имеет серьезное влияние на окружающую среду и может быть опасным для живых организмов и экосистем в целом.
Воздействие Hgo на окружающую среду может происходить через различные пути. Одним из них является выбросы из промышленных и энергетических источников, в результате которых ртутный пар попадает в атмосферу. Затем Hgo может оседать на поверхности почвы, водных ресурсов и растительности, что приводит к его накоплению в экосистемах.
Последствия выбросов Hgo в окружающую среду могут быть катастрофическими. Во-первых, ртутный пар может проникать через легкие в организмы живых существ, включая человека, и вызывать серьезные заболевания, такие как отравление ртутью и нарушения нервной системы. Во-вторых, Hgo является тяжелым металлом, и его накопление в почве и воде может быть опасным для микроорганизмов, растений и животных, которые могут поглотить ртути и передать ее по пищевой цепи.
Одним из способов контроля негативного влияния Hgo на окружающую среду является ограничение выбросов и применение методов очистки и обработки промышленных и сточных вод. Также важно проводить мониторинг содержания ртутного пара в воздухе, почве и водных источниках, чтобы своевременно выявлять и предотвращать загрязнение Hgo.
- Для минимизации негативного влияния Hgo на окружающую среду также следует регулировать использование ртути в промышленности и бытовых целях, а также отслеживать и соблюдать экологические стандарты и нормативы.
- Необходимо проводить обучение и информирование населения о вреде Hgo и способах защиты от его воздействия.
- Природные механизмы очистки и снижения содержания Hgo в окружающей среде также могут использоваться, например, хемосорбция через активные составы почвы и биосорбцию через микроорганизмы и растения.
В целом, необходимо предпринимать все возможные меры для предотвращения загрязнения окружающей среды Hgo и минимизации его негативного воздействия на живые системы и экосистемы.
Возможные риски при работе с Hgo
Отравление: Hgo, или оксид ртути, является очень токсичным веществом и может вызывать серьезные отравления при попадании на кожу, через дыхательные пути или пищеварительную систему. При ингаляции может возникать задержка дыхания, головокружение и нарушение координации движений. При попадании на кожу возможно раздражение, покраснение и ожоги.
Канцерогенность: Ингаляция Hgo может увеличить риск развития раковых заболеваний, особенно рака легких и почек. Долгосрочное воздействие на организм может привести к серьезным последствиям для здоровья.
Воздействие на нервную систему: Hgo может оказывать негативное воздействие на нервную систему. При длительном контакте с веществом могут возникать головные боли, потеря памяти, нарушение координации движений и даже возможность развития неврологических заболеваний.
Воздействие на пищеварительную систему: При попадании Hgo в организм через пищеварительную систему возможны ожоги и повреждения слизистой оболочки желудка и кишечника. Это может вызвать боли, кровотечение и другие серьезные проблемы со здоровьем.
Аллергические реакции: У некоторых людей может возникать аллергическая реакция на контакт с Hgo. Это может проявляться в виде высыпаний, зуда, отеков и других симптомов аллергии.
Для минимизации рисков при работе с Hgo необходимо соблюдать все предосторожности, использовать средства индивидуальной защиты, такие как перчатки, маски и защитные очки. Также важно хранить вещество в специальных контейнерах, чтобы предотвратить его распространение и возможные аварии.
Меры предосторожности при хранении и транспортировке Hgo

Hgo - это оксид металла, который является потенциально опасным веществом. При хранении и транспортировке Hgo необходимо соблюдать ряд мер предосторожности, чтобы предотвратить возможные аварии или вредное воздействие на окружающую среду и здоровье людей.
1. Упаковка и маркировка: При транспортировке Hgo важно использовать специальные упаковочные материалы, обеспечивающие безопасность и надежность контейнеров. Контейнеры должны быть четко помечены, указывающими содержание и опасность вещества.
2. Температурный режим: Hgo должен храниться при определенной температуре, которая указана в специальных инструкциях. Это позволит предотвратить возможное изменение химических свойств вещества и снизить риск аварийной ситуации.
3. Вентиляция: Хранение Hgo требует хорошей вентиляции помещения. Это поможет избежать скопления вредных испарений и уменьшит риск отравления и возгорания.
4. Размещение: Hgo следует хранить в специальных областях, изолированных от других химических веществ. Такое размещение поможет избежать возможной реакции веществ с другими веществами и предотвратит аварийные ситуации.
5. Обучение персонала: Сотрудники, занимающиеся хранением и транспортировкой Hgo, должны быть обучены основным правилам и мерам предосторожности при работе с опасными веществами. Это позволит им быть готовыми к возможным ситуациям и снизить риск возникновения аварий.
6. Личная защита: При работе с Hgo необходимо использовать специальные средства индивидуальной защиты, такие как защитные рукавицы, маски, средства защиты глаз и одежду. Это поможет предотвратить попадание вредных веществ на кожу и дыхательные пути.
Все эти меры предосторожности при хранении и транспортировке Hgo являются важными для обеспечения безопасности и минимизации рисков связанных с использованием этого вещества. Следуя этим мерам, можно предотвратить возможные аварии и негативные последствия для окружающей среды и здоровья людей.
Возможные взаимодействия Hgo с другими веществами
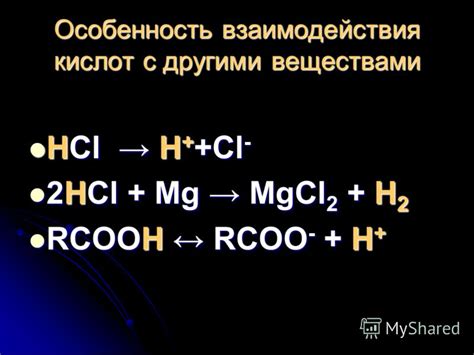
Оксид металла Hgo (ртуть(II) оксид) может взаимодействовать со многими другими веществами, проявляя различные химические свойства.
Вода: Hgo не растворяется в воде, однако может образовывать соединение с водой - ртути оксидогидрат (HgO·xH2O), которое обладает кислотными свойствами.
Кислоты и щелочи: Hgo образует сильные соединения с кислотами, образуя оксиды ртути различной степени окисления. С щелочами также могут образовываться соединения ртути.
Аммиак: Hgo реагирует с аммиаком, образуя ртути аммиагидраты, которые обладают тугоплавкими свойствами и используются в процессе химического синтеза.
Сероводород: Hgo может реагировать с сероводородом, образуя ртуть(II) сульфид, который обладает слабой растворимостью в воде и используется в аналитической химии.
Хлор и бром: Hgo реагирует с хлором и бромом, образуя соответствующие хлориды и бромиды ртути. Эти соединения обладают ядовитыми свойствами и используются в промышленности.
Кислород: Hgo может реагировать с кислородом, образуя ртуть(II) оксид (HgO), который является одним из наиболее стабильных оксидов ртути.
Органические соединения: Hgo может взаимодействовать с органическими соединениями, образуя различные соединения ртути. Эти соединения обладают разнообразными химическими свойствами и находят применение в органическом синтезе.
Вопрос-ответ

Что такое Hgo?
Hgo - это химическая формула оксида металла монокислорода.
Какие основные свойства Hgo?
Hgo - это тяжелая бесцветная жидкость с высоким показателем плотности и низким кипящим точкой.
Какова структура Hgo?
Структура Hgo состоит из молекул двухатомного монокислорода, связанных ковалентными связями.
Каковы применения Hgo в промышленности?
Hgo широко используется в научных и исследовательских лабораториях, а также в различных промышленных процессах, включая производство стекла, электроники и оптики.
