Hcl (хлорид водорода) является химическим соединением, состоящим из элементов водорода (H) и хлора (Cl). Вопрос о том, является ли Hcl металлом или неметаллом, вызывает дискуссии среди ученых.
Один из подходов к этому вопросу основан на периодической таблице элементов. В периодической таблице, углеподобные неметаллы располагаются в верхнем правом углу, а металлы - в левом нижнем углу. Хлорид водорода принадлежит к группе галогенов, находящейся в 17-ом столбце. Здесь располагаются элементы, образующие кислоты, и обычно считаются неметаллами.
Однако, несмотря на это расположение в периодической таблице, некоторые ученые склонны рассматривать Hcl не только как неметалл, но и как одну из наиболее реактивных кислот. Это связано с его способностью высвобождать водородные и хлоридные ионы при взаимодействии с прочими веществами.
Таким образом, можно сказать, что Hcl в основном рассматривается как неметалл, влияет на pH окружающей среды и обладает кислотными свойствами. Однако, из-за своей реактивности и способности образовывать ионы, некоторые ученые могут вести дискуссию о его классификации.
Что такое Hcl
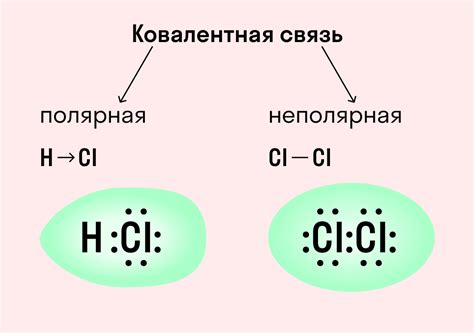
Hcl (хлорид водорода) - химическое соединение, состоящее из одного атома водорода и одного атома хлора. Это ярко-зеленого цвета газ с резким и характерным запахом.
Hcl является одной из самых распространенных неорганических кислот. Она образуется в результате реакции хлорида натрия (NaCl) с серной кислотой (H2SO4). Hcl также можно получить путем электролиза соляной кислоты (H2O + HCl).
Hcl широко используется в химической промышленности, лабораторной практике и бытовых условиях. Он применяется в процессе производства пластмасс, удобрений, синтеза органических соединений, очистки металлов и многих других процессах.
Hcl является сильной кислотой и обладает коррозионными свойствами. Он может реагировать с металлическими поверхностями, оказывая разрушительное воздействие. При попадании Hcl на кожу или слизистые оболочки, он может вызывать ожоги и раздражение.
Основные свойства Hcl

Hcl (хлороводород) является химическим соединением, образованным из хлора и водорода. Оно имеет молекулярную структуру и является газообразным в своем стандартном состоянии.
Физические свойства:
- Хлороводород обладает резким, задушевным запахом.
- Он является безцветным газом с высокой плотностью.
- Температура кипения Hcl составляет около -85.05 °C, а температура плавления -114.2 °C.
- Hcl хорошо растворяется в воде и образует с ней кислотный раствор, известный как соляная кислота.
Химические свойства:
- Хлороводород является сильной кислотой и может образовывать соли, называемые хлоридами.
- Он обладает коррозионным действием и может реагировать с металлами, образуя соответствующие хлориды и выделяя водородный газ.
- Взаимодействие Hcl с щелочами приводит к образованию солей и воды.
Применение:
- Соляная кислота, получаемая из разбавленного Hcl, широко используется в различных промышленных процессах, таких как производство удобрений, очистка металлов и производство пластиков.
- Хлороводород также используется в медицине для производства лекарственных препаратов и дезинфицирующих растворов.
- Он является важным реагентом в органической химии и используется для синтеза различных соединений.
Физические свойства Hcl

Hcl (хлорид водорода) – это бесцветный газ с резким запахом. Растворы хлорида водорода обладают сильной кислотностью и широко используются в химической промышленности. Они образуют белого красителя, используемые в текстильной промышленности.
Точка плавления Hcl составляет -114,7°C, а точка кипения – -85°C. Это газ склонен к образованию дымок, так как при контакте с воздухом смешивается с водяными паров, образуя аэрозоль. Имеет плотность 1,49 г/см³, что существенно выше плотности воздуха и позволяет ему накапливаться в нижних слоях атмосферы.
Вода хорошо растворяет Hcl, образуя соляную кислоту. Растворы хлорида водорода имеют большие промышленные применения, например, для получения хлористого железа и хлорида алюминия. Они также используются для обработки металлических поверхностей и как лабораторные реагенты.
Химические свойства HCl
Растворимость в воде: HCl хорошо растворяется в воде, образуя соляную кислоту. Реакция растворения сопровождается выделением большого количества тепла. Раствор HCl в воде обладает кислотными свойствами.
Кислотные свойства: HCl является одной из самых сильных известных кислот. Она реагирует с основаниями, оксидами и гидроксидами, образуя соли и воду.
Реакция с металлами: HCl реагирует с большинством металлов, образуя соли и выделяя водород. Реакция происходит при образовании пузырьков водорода, и металл полностью растворяется в растворе соляной кислоты.
Окислительные свойства: HCl не обладает окислительными свойствами. В ряду реакций с веществами различной окислительной способностью HCl выступает в качестве восстановителя, передавая электроны другим веществам.
Коррозионность: HCl обладает высокой коррозионной активностью. Вещество способно разрушать металлы и иные материалы, такие как резина или пластик, при длительном контакте.
Действие на органические вещества: HCl является активным реагентом в органической химии. Оно может проводить реакции с различными органическими соединениями, приводя к образованию новых веществ.
Как Hcl используется
Hcl (соляная кислота) является одной из наиболее широко используемых химических соединений в промышленности и лабораториях. Её многообразные свойства и относительная доступность делают её незаменимым веществом во многих областях.
Одним из основных применений Hcl является производство различных химических соединений. Она может быть использована в качестве исходного материала для получения других кислот, солей и органических соединений. Также Hcl широко используется в процессе ферментации для получения продуктов, таких как этиловый спирт или лимонная кислота.
Соляная кислота является важным компонентом в процессах очистки воды и очистке металлов. Она может использоваться для устранения загрязнений и окалины на металлических поверхностях, а также для образования гальванической защитной пленки на металлах, предотвращающей их коррозию.
Кроме того, Hcl применяется в лабораториях в химических анализах и синтезах. Она используется для регулирования кислотно-щелочного равновесия в реакциях, а также для очистки и обезжиривания оборудования и стекловидных приборов.
Hcl также находит применение в медицине. Она может быть использована для промывания ран и ожогов, а также для удаления бородавок и других образований на коже. В некоторых случаях она может использоваться в качестве антисептика и дезинфицирующего средства.
Конечно, Hcl требует тщательной и безопасной обработки из-за её высокой коррозионной активности и токсичности. При использовании Hcl необходимо строго соблюдать правила безопасности и работать в хорошо проветриваемом помещении или в специальных вытяжных шкафах.
Применение Hcl в промышленности
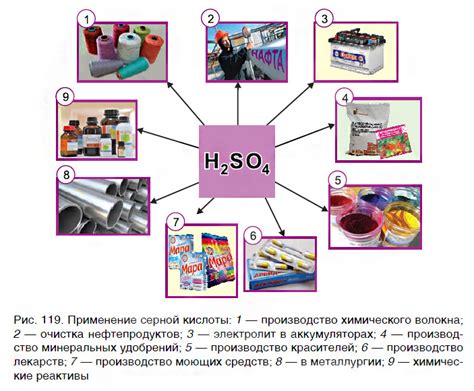
Хлорид водорода (HCl) – одно из самых важных химических соединений, которое нашло широкое применение в различных отраслях промышленности.
1. Химическая промышленность:
Хлорид водорода используется как основной источник хлора для производства различных веществ, таких как поливинилхлорид, хлорамин, хлорированные растворители и другие органические хлориды. Он также применяется в процессе синтеза пластмасс и жидкостей для охлаждения, а также служит важным компонентом при производстве дезинфицирующих средств.
2. Фармацевтическая промышленность:
Хлорид водорода используется в процессе синтеза многих фармацевтических препаратов, таких как аспирин, парацетамол и много других. Он служит активатором реакций, а также используется для получения чистых химических соединений.
3. Металлургическая промышленность:
HCl применяется для очистки и обработки металлов, таких как сталь, алюминий и медь. Он используется для удаления оксидов и примесей с поверхности металла, что повышает его качество и позволяет производить конечную продукцию высокой прочности.
4. Нефтехимическая промышленность:
Хлорид водорода используется при производстве нефтехимических продуктов, таких как пластик, синтетические каучуки, волокна и полимеры. Он служит катализатором реакций и используется для получения высококачественных материалов.
5. Производство электроники:
HCl применяется при производстве электронных компонентов, таких как полупроводники и микрочипы. Он служит для очистки и обработки поверхности материалов, что позволяет получить качественные и стабильные элементы.
В итоге, применение хлорида водорода в промышленности невозможно переоценить. Он является важным компонентом производства различных химических веществ, способствует повышению качества и производительности продукции в различных отраслях промышленности.
Применение Hcl в научных исследованиях
Hcl (соляная кислота) широко используется в научных исследованиях в различных областях знаний. Ее химические свойства и реактивность делают ее полезным инструментом для проведения экспериментов и анализа. Ниже представлены несколько областей, в которых Hcl применяется в научных исследованиях.
Химия и анализ
В химических исследованиях Hcl используется для проведения различных химических реакций. Она может быть использована для выделения различных веществ из смесей, регулирования pH растворов, разрушения органических соединений и многого другого. Hcl также является одним из важных компонентов для поддержания чистоты лабораторного оборудования и посуды.
Материаловедение
Hcl используется для анализа и исследования различных материалов, включая металлы и сплавы. Она способствует удалению окисленных слоев с поверхности металла, что позволяет более точно изучить его химические свойства и структуру. Hcl также может использоваться для травления и обработки материалов перед дальнейшим изучением.
Биология и медицина
Hcl применяется в биологических и медицинских исследованиях, особенно при изучении желудочной секреции и заболеваний, связанных с пищеварительной системой. Она может использоваться для создания условий, приближенных к окружающим в желудке, и для изучения взаимодействия с пищеварительными ферментами и другими веществами. Также Hcl может быть использована для обеззараживания и промывки медицинского оборудования.
Экология и охрана окружающей среды
В экологических исследованиях Hcl может использоваться для анализа содержания различных химических веществ в воде, почве и воздухе. Она может быть использована для определения уровня загрязнения окружающей среды различными веществами, а также для очистки и обеззараживания примеров с использованием данного реактива.
В целом, Hcl имеет широкий спектр применений в научных исследованиях и продолжает оставаться востребованным реагентом во многих областях познания.
Вопрос-ответ

Что такое HCl?
HCl — это химическая формула для соединения хлороводород, которое широко известно как соляная кислота.
Можно ли назвать HCl металлом?
Нет, HCl не является металлом. HCl — это бинарное неорганическое соединение, состоящее из водорода (H) и хлора (Cl).
Почему HCl считается неметаллом?
HCl считается неметаллом из-за его химической структуры и свойств. Неметаллы, в отличие от металлов, не обладают металлическим блеском, хорошей электропроводностью и могут формировать ковкие сплавы.
