Фосфорная кислота (H3PO4) является одним из наиболее распространенных неорганических кислот. Она имеет широкое применение в различных отраслях промышленности, включая производство удобрений, пищевую промышленность и фармацевтику. Однако, когда речь идет о ее химической природе, возникает вопрос: является ли H3PO4 оксидом металла или неметалла?
Для ответа на этот вопрос необходимо рассмотреть структуру и свойства фосфорной кислоты. Формула H3PO4 указывает на присутствие трех протонов и одного атома фосфора, что делает ее кислотой. Кислоты обычно классифицируются как неметаллы, также входящие в эту категорию элементы имеют склонность отдавать электроны в химических реакциях. Однако некоторые исследователи считают, что фосфорная кислота может рассматриваться и как оксид металла.
Поддерживающие эту точку зрения аргументируют, что фосфор - химический элемент, который находится в периодической системе в периоде 3 и группе 15, что делает его металлом. Кроме того, свойства фосфора, такие как его малая электроотрицательность и высокая температура плавления, свидетельствуют в пользу его металлической природы. Таким образом, можно утверждать, что H3PO4 является оксидом металла.
Молекулярное строение H3PO4: характеристика соединения
Молекулярное строение H3PO4 характеризуется наличием трех молекул водорода (H) и одной молекулы фосфора (P) в соединении. Фосфор в составе этого соединения образует две двойные связи и одну одинарную связь с кислородом (O), что придает молекуле характеристику кислотности. H3PO4, поэтому, является кислотой и имеет название фосфорная кислота.
Молекула H3PO4 имеет полностью разрезанную трехмерную структуру, атомы фосфора и кислорода являются центральными, а водородные атомы связаны с атомами кислорода. Между атомом фосфора и атомом кислорода образуется положительный и отрицательный заряд соответственно. Поэтому в молекуле фосфорной кислоты можно выделить кислородные и гидрогенфосфатные группы.
В фосфорной кислоте имеется множество механизмов взаимодействия между молекулами H3PO4. Вода и различные соединения, которые содержат группы ацида, могут проявлять различное влияние на реакцию молекулы фосфорной кислоты. Именно наличие гидрогенфосфатных групп обуславливает ее способность к образованию солей и эстеров, в результате чего молекула H3PO4 является важным компонентом в процессах органического синтеза.
Таким образом, молекулярное строение H3PO4 характеризуется наличием трех атомов водорода и одного атома фосфора. Оно обладает высокой кислотностью, что делает H3PO4 важным соединением во многих химических процессах.
Оксиды металлов: определение и классификация
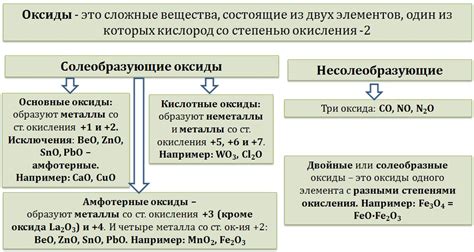
Оксиды металлов - это неорганические соединения, состоящие из кислорода и одного или более металлов. Они являются основными оксидами металлов и широко распространены в природе. Оксиды металлов могут иметь различные составы и свойства, в зависимости от типа и количества металла, присутствующего в соединении.
Классификация оксидов металлов основана на электрохимических свойствах и степени окисления металла. Существует несколько основных типов оксидов металлов:
- Основные оксиды - это оксиды металлов, которые образуют щелочные растворы при реакции с водой. Они обладают выраженными щелочными свойствами и растворяются в воде, образуя гидроксиды металлов. Примерами основных оксидов могут служить оксид натрия (Na2O) и оксид калия (K2O).
- Кислотные оксиды - это оксиды металлов, которые образуют кислотные растворы при взаимодействии с водой. Они обладают выраженными кислотными свойствами и образуют кислоты при реакции с водой. Примерами кислотных оксидов могут служить оксид серы (SO3) и оксид азота (NO2).
- Амфотерные оксиды - это оксиды металлов, которые могут образовывать как щелочные, так и кислотные растворы при реакции с водой. Они обладают и щелочными, и кислотными свойствами и способны проявлять амфотерность. Примером амфотерного оксида является оксид алюминия (Al2O3).
Оксиды металлов широко используются в различных отраслях промышленности и научных исследованиях. Они могут быть использованы как катализаторы, добавки в лаках и красках, материалы для производства керамики и стекла, а также в других областях, где требуется специфическая химическая реактивность и свойства металла.
Металлические и неметаллические элементы: основные отличия
Металлические и неметаллические элементы - основные классы веществ, из которых состоят все вещества в природе. Они имеют ряд существенных отличий друг от друга.
Металлические элементы:
- Обладают характерным металлическим блеском;
- Проводят электричество и тепло благодаря свободному движению электронов в своей структуре;
- Образуют положительно заряженные ионы (катионы) в химических реакциях;
- Имеют хорошую термическую и электрическую проводимость;
- Часто обладают высокой пластичностью и деформируются без разрушения.
Неметаллические элементы:
- Не обладают металлическим блеском и характерным металлическим свойствам;
- Не проводят электричество и тепло;
- Образуют отрицательно заряженные ионы (анионы) в химических реакциях;
- Обычно обладают хрупкостью и способностью к разрушению при деформации;
- Часто образуют молекулы, состоящие из двух или более атомов.
Металлические элементы обычно представлены в периодической системе элементов слева и по центру, а неметаллические элементы - справа и выше периодической таблицы. Однако, есть элементы, которые обладают свойствами и металлов, и неметаллов, и называются полуметаллами или металлоидами.
Фосфор: свойства и химический элемент

Фосфор - химический элемент таблицы Mendeleev с атомным номером 15 и обозначением P. Он относится к группе пяти металлоидов и является одним из основных строительных блоков живых организмов.
Фосфор имеет много интересных свойств. Он обладает низкой температурой плавления и кипения, что делает его химическим элементом средней активности. Фосфор является очень реактивным веществом и может легко соединяться с другими элементами.
Большинство фосфорных соединений являются неорганическими, такими как фосфаты, которые являются основной формой, в которой фосфор существует в природе. Эти соединения широко используются в агропромышленном секторе, в производстве удобрений, моющих средств и пищевых добавок.
Фосфор играет важную роль в биологических процессах. Он является неотъемлемой частью ДНК и РНК, основных молекул, отвечающих за передачу и хранение генетической информации. Также фосфор участвует в ферментативных реакциях и обмене энергии в организме.
Кроме того, фосфор используется в производстве огнеупорных материалов, стекла и фармацевтических препаратов. Он также имеет применение в электронике и производстве полупроводников, благодаря своим полупроводниковым свойствам.
Учитывая все эти факты, неудивительно, что фосфор является одним из самых важных и необходимых химических элементов для жизни на Земле.
Формула и название соединения H3PO4

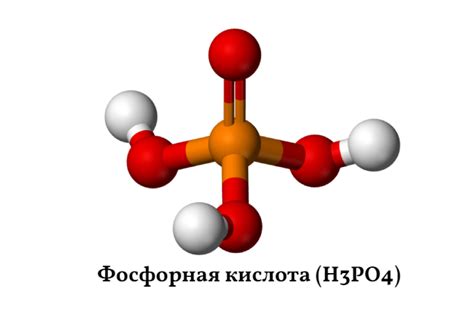
H3PO4 представляет собой химическое соединение, состоящее из трех молекул водорода, одной молекулы фосфора и четырех молекул кислорода. Формула этого соединения указывает на наличие трех атомов водорода, одного атома фосфора и четырех атомов кислорода.
Соединение H3PO4 носит название фосфорнокислота или ортофосфорная кислота. Он является одним из наиболее распространенных вариантов фосфорных кислот. Фосфорная кислота получает свое название за счет наличия атома фосфора, который является центральным элементом в данном соединении.
Фосфорная кислота (H3PO4) является кислотой средней силы и широко применяется в различных областях, таких как промышленность, медицина, сельское хозяйство и другие. Она используется для производства удобрений, а также в качестве пищевой добавки для регулирования кислотности продуктов питания.
Формула и название соединения H3PO4 указывают на его состав и свойства, что позволяет идентифицировать и использовать данное соединение в различных областях науки и промышленности.
Оксиды фосфора: разновидности и свойства

Оксиды фосфора являются неорганическими соединениями, которые образуются в результате реакции фосфора с кислородом. В зависимости от количества кислорода, существует несколько различных оксидов фосфора.
Наиболее распространенным и хорошо изученным оксидом фосфора является трехокись фосфора (P2O3). Данное соединение представляет собой белый кристаллический порошок, который растворяется в воде, образуя слабую кислоту - фосфорнокислоту.
Еще одним оксидом фосфора является пентокись фосфора (P2O5), который представляет собой белый кристаллический порошок. Пентокись фосфора является окислителем и может вступать в реакцию с различными соединениями, образуя фосфорную кислоту.
Одной из особенностей оксидов фосфора является их высокая токсичность. При попадании в организм трехокись фосфора или пентокись фосфора, возможны различные патологические процессы и отравления. Поэтому при работе с данными веществами необходимо соблюдать все предписанные меры безопасности.
Таким образом, оксиды фосфора представляют собой важные соединения, которые находят применение в различных отраслях промышленности и науки. Они обладают определенными свойствами и могут использоваться в химических реакциях для получения других соединений фосфора.
Фосфорная кислота в природе и промышленности: основные применения
Фосфорная кислота (H3PO4) является одной из наиболее распространенных кислот как в природе, так и в промышленности. Ее основное применение связано с прямым или косвенным воздействием на различные процессы и материалы.
В природе фосфорная кислота играет важную роль в круговороте фосфора. Она участвует в формировании почвы и является необходимой для жизнедеятельности растений. Фосфорная кислота применяется в сельском хозяйстве как компонент удобрений для повышения плодородия почвы и увеличения урожайности.
В промышленности фосфорная кислота также находит множество применений. Она используется в производстве удобрений, фармацевтических продуктов, пищевых добавок и моющих средств. Фосфорная кислота является важным компонентом при производстве стекла, металлургических и электронных материалов.
Одним из наиболее значимых применений фосфорной кислоты является ее использование в производстве горючего и смазочных материалов. Добавленная в бензин или моторное масло, она улучшает качество и эффективность сгорания топлива.
Кроме того, фосфорная кислота применяется в области электроники и аккумуляторных батарей. Она используется для производства полупроводников, химических источников тока и других электронных компонентов. Фосфорная кислота также является неотъемлемой частью процесса производства фотографических материалов, таких как пленки и бумага.
В заключение, фосфорная кислота является многоцелевым веществом, которое широко применяется и в природе, и в промышленности. Ее основные области применения включают сельское хозяйство, производство удобрений, стекла, металлургических и электронных материалов, горючего и смазочных материалов, а также в области электроники и фотографии.
H3PO4: оксид металл или неметалл?

H3PO4 представляет собой соединение, известное под названием фосфорная кислота. Вопрос о том, является ли H3PO4 оксидом металла или неметалла, требует более детального рассмотрения.
С точки зрения общей кислотности, фосфорная кислота проявляет характеристики кислоты, значит, она содержит неметаллический элемент. В этих кислотах атом водорода связан с кислородом и неметаллом, что подтверждает неметаллический характер соединения.
Но если рассмотреть структурную формулу H3PO4, можно заметить наличие фосфора - элемента, обладающего металлическими свойствами. Однако, следует учитывать, что в данном соединении фосфор находится в окислительном состоянии +5. Также фосфорная кислота имеет кислотные свойства, что свидетельствует о наличии неметаллических характеристик.
Таким образом, фосфорная кислота H3PO4 является сложным соединением, которое охватывает как металлические элементы (фосфор), так и неметаллические элементы (водород и кислород). Такое сочетание свойств делает ее уникальным соединением с обоими характеристиками.
Вопрос-ответ

Чем является H3PO4: оксид металл или неметалл?
H3PO4 (ортофосфорная кислота) является кислотой, а не оксидом. Так как она содержит водород, классифицируется как неметалл.
Как классифицировать H3PO4: металл или неметалл?
H3PO4 (ортофосфорная кислота) является неметаллом. Она состоит из молекул, в которых присутствуют как металлические, так и неметаллические элементы, но в данном соединении преобладают неметаллические свойства.
Почему H3PO4 является неметаллом?
H3PO4 (ортофосфорная кислота) является неметаллом, поскольку она состоит из неметаллических элементов (фосфора и кислорода). Неметаллы обычно обладают отрицательным зарядом и образуют катионы, в то время как металлы обычно образуют анионы.
