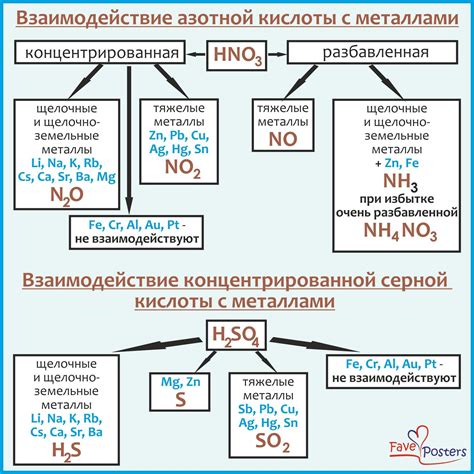
Взаимодействие разбавленной серной кислоты (H2SO4) с металлами является одной из основных реакций химической науки. Эта реакция происходит при контакте металлов со средой, содержащей серную кислоту. При данной реакции металлы вступают в химический контакт с серной кислотой, что приводит к выделению водорода и образованию сульфатов металлов.
Реакция металлов с серной кислотой обычно сопровождается выделением водорода. Водород выделяется в виде пузырьков, которые можно наблюдать на поверхности металла или в реакционной среде. Эта реакция является очень активной и сопровождается эволюцией тепла.
Серная кислота обладает высокой степенью кислотности, поэтому она способна растворять многие металлы. Но не все металлы реагируют с H2SO4 одинаково. Некоторые металлы реагируют с кислотой только при нагревании, например, медь (Cu), железо (Fe), алюминий (Al). Другие металлы реагируют сразу, например, цинк (Zn), магний (Mg), свинец (Pb).
Взаимодействие серной кислоты с металлами
Серная кислота (H2SO4) является одним из наиболее распространенных химических соединений. Она обладает сильными кислотными свойствами и может взаимодействовать с различными металлами, образуя соли и выделяя водород.
Взаимодействие серной кислоты с металлами основывается на реакции окисления-восстановления. Металл представляет собой восстановитель, который отдаёт электроны серной кислоте, которая в свою очередь становится восстановителем и принимает эти электроны.
В результате данной реакции образуются соли серной кислоты. Например, реакция между серной кислотой и железом (Fe) даёт соль сульфата железа (FeSO4).
Однако, не все металлы могут взаимодействовать с серной кислотой. Некоторые металлы, например, золото (Au) и платина (Pt), являются химически инертными и не окисляются кислотой при обычных условиях.
Взаимодействие серной кислоты с металлами может происходить при нагревании, в результате чего образуются соответствующие соли. Также, серная кислота может использоваться для очистки поверхности металлов от окислов и других загрязнений, поскольку она обладает довольно сильными окислительными свойствами.
В целом, взаимодействие серной кислоты с металлами представляет собой важный процесс в химии, используемый в различных промышленных и лабораторных целях.
Химические свойства серной кислоты

Серная кислота (H2SO4) – это одна из самых распространенных и важных кислот в химии. Она обладает множеством химических свойств, которые делают ее полезной в различных областях промышленности и научных исследований.
Первое свойство серной кислоты – ее кислотность. Она является одной из самых сильных кислот, которая может растворять множество различных веществ. Кроме того, серная кислота обладает окислительными свойствами, способностью окислять многие вещества и реагировать с ними.
Серная кислота также обладает дегидратирующими свойствами. Она способна извлекать воду из других веществ, что делает ее полезной в различных процессах, например, в синтезе органических соединений.
Серная кислота может реагировать с металлами, образуя соли серной кислоты. При этом происходит выделение водорода и образование серы. Эта реакция может происходить с разными металлами, такими как железо, цинк, медь и другие.
Кроме того, серная кислота является сильным окислителем в реакциях с некоторыми веществами. Она может окислять множество соединений, включая органические вещества. Это свойство делает серную кислоту полезной в процессах окисления и синтеза органических соединений.
Также следует отметить, что серная кислота обладает коррозионными свойствами. Она может вызывать разрушение и повреждение различных материалов, таких как металлы и прочие вещества.
Процесс взаимодействия серной кислоты с металлами
Серная кислота (H2SO4) является одной из наиболее распространенных и сильных кислот. Ее взаимодействие с металлами является одной из основных реакций в химии.
В ходе этого процесса серная кислота действует как окислитель, при этом может происходить выделение газа и образование солей.
Когда серная кислота взаимодействует с активными металлами, такими как натрий (Na) или калий (K), реакция происходит с выделением водорода. При этом металл окисляется, а серная кислота восстанавливается:
2Na + H2SO4 → Na2SO4 + H2
Серная кислота также может реагировать с некоторыми металлами, образуя соли серной кислоты, известные как сульфаты. Например, взаимодействие серной кислоты с железом (Fe) приводит к образованию сульфата железа (FeSO4):
Fe + H2SO4 → FeSO4 + H2
Каждая реакция взаимодействия серной кислоты с металлами может иметь разные условия протекания, такие как температура или концентрация кислоты, и приводить к образованию различных продуктов.
Таким образом, процесс взаимодействия серной кислоты с металлами имеет значительное химическое и практическое значение, так как позволяет получать соли, используемые в различных отраслях промышленности и научных исследований.
Применение серной кислоты в производстве
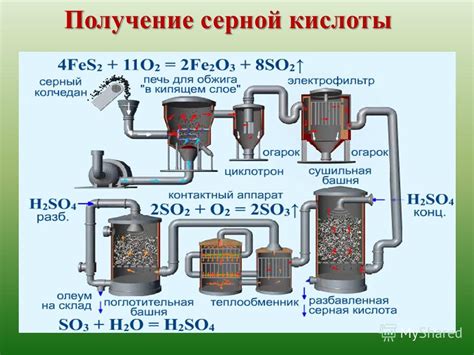
Серная кислота (H2SO4) является одним из наиболее широко используемых химических соединений в промышленности. Ее применение охватывает множество отраслей и процессов.
Одним из основных применений серной кислоты является производство удобрений, таких как аммиачная селитра и суперфосфаты. Серная кислота используется для получения сульфата аммония и сульфата калия, которые являются ключевыми компонентами удобрений для растений.
Также серная кислота широко применяется в процессах гальванического покрытия. Она используется для очистки металлических поверхностей перед нанесением защитного покрытия, а также в процессе электролиза для осаждения металлов на подложку.
В производстве взрывчатых веществ, например, тринитротолуола (ТНТ), серная кислота используется для нитрации органических соединений. Она обеспечивает реакцию с нитротолуолом, что приводит к образованию стабильного и высокоэнергетичного продукта - ТНТ.
Серная кислота также находит свое применение в производстве красителей и пигментов. Она используется для синтеза органических соединений, которые придают окраску различным материалам, таким как текстильные волокна, пластмассы и краски.
Кроме того, серная кислота играет важную роль в рафинировании нефти. Она используется для удаления примесей, таких как серы и ароматических соединений, из сырой нефти. Этот процесс позволяет получить более чистые и качественные нефтепродукты.
Применение серной кислоты в производстве является одним из ключевых факторов развития различных отраслей промышленности. Ее свойства и широкий спектр применений делают ее важным и неотъемлемым компонентом производственного процесса.
Вопрос-ответ

Какие металлы реагируют с разбавленной серной кислотой?
Разбавленная серная кислота может реагировать с различными металлами, такими как железо, цинк, алюминий и многими другими.
Какова сущность реакции между разбавленной серной кислотой и металлами?
Реакция между разбавленной серной кислотой и металлом происходит при образовании соли и выделении водорода. В результате этой реакции образуется сульфат металла и молекулярный водород.
Каковы условия реакции между разбавленной серной кислотой и металлами?
Обычно для реакции требуется наличие разбавленной серной кислоты и металла. Также необходимо обеспечить некоторое время контакта между кислотой и металлом для того, чтобы реакция могла протекать.
Каким образом происходит реакция между разбавленной серной кислотой и металлами?
Реакция происходит путем окисления металла серной кислотой. В ходе реакции связи между атомами металла и атомами серной кислоты разрываются, образуя соль и водород.
