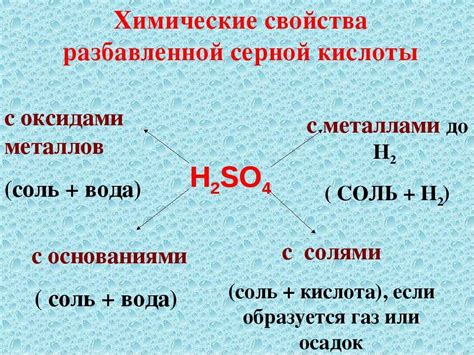
Оксиды металлов представляют собой неорганические соединения, состоящие из кислорода и металлического элемента. Они могут быть различных типов, включая щелочные, кислотные и амфотерные оксиды. Взаимодействие оксидов металлов с различными кислотами, включая H2SO4 (серную кислоту), является важной темой изучения химии.
Взаимодействие H2SO4 с оксидами металлов может привести к ряду реакций, в результате которых образуются соли и вода. Например, щелочные оксиды металлов, такие как Na2O или K2O, реагируют с H2SO4, образуя соли и обильное выделение тепла. В таких реакциях H2SO4 действует в роли кислоты, а щелочные оксиды - в роли оснований.
С другой стороны, амфотерные оксиды металлов, такие как Al2O3 или ZnO, могут реагировать как с кислотами, так и с основаниями. Взаимодействие H2SO4 с амфотерными оксидами приводит к образованию солей, но возможны также реакции гидролиза, при которых оксид металла образует кислоту или основание.
Знание о реакциях H2SO4 с оксидами металлов имеет практическое применение в различных сферах, таких как производство удобрений, очистка металлических поверхностей, а также в химическом синтезе и аналитической химии. Понимание данных реакций способствует усовершенствованию технологических процессов и созданию новых материалов с нужными свойствами.
Реакция оксидов металлов с H2SO4
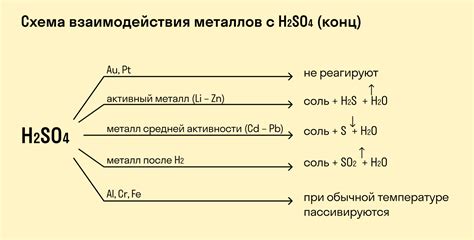
Взаимодействие оксидов металлов с серной кислотой (H2SO4) является важным химическим процессом. Оксиды металлов, будучи связью с кислородом, обладают основными свойствами и могут реагировать с кислотами. Результатом такой реакции является образование соответствующей соли и воды.
Реакция оксида металла с серной кислотой происходит следующим образом: оксид металла (MxOy) реагирует с H2SO4, образуя соль металла и воду. В результате этой реакции основная активность оксида металла проявляется в его способности давать ОН-ионы при контакте с кислотой.
Примеры реакций оксидов металлов с серной кислотой:
- Оксид железа (Fe2O3) реагирует с H2SO4, образуя соль железа (Fe2(SO4)3) и воду:
- Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
- Оксид меди (CuO) реагирует с H2SO4, образуя соль меди (CuSO4) и воду:
- CuO + H2SO4 → CuSO4 + H2O
Реакция оксидов металлов с H2SO4 широко используется в химической промышленности. Например, полученные соли меди могут использоваться в гальваническом производстве и производстве красителей. Полученные соли железа находят применение в лекарствоведении, при производстве красок и в других отраслях промышленности.
Оксиды металлов и их свойства
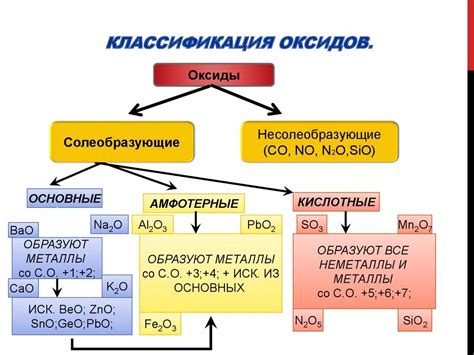
Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Они образуются в результате реакции металла с кислородом при окислении, что делает их одними из наиболее широко распространенных соединений в природе.
Оксиды металлов обладают различными свойствами, в зависимости от химического состава и структуры. Некоторые оксиды металлов являются базическими оксидами, способными образовывать щелочные растворы и реагировать с кислотами. Такие оксиды обычно обладают высокой растворимостью в воде и имеют щелочной pH.
Другие оксиды металлов являются амфотерными, то есть способны как образовывать кислотные соединения, так и щелочные. Это связано с особенностями электронной структуры металла и его способностью к образованию различных кислотных или щелочных ионов. Амфотерные оксиды имеют разнообразные свойства и применяются в различных областях науки и техники.
Оксиды металлов также часто используются в качестве катализаторов в химических реакциях, благодаря своей активности и способности взаимодействовать с другими веществами. Они играют важную роль в производстве различных отраслей промышленности, таких как нефтехимия, фармацевтика, электроника и др.
В реакции с серной кислотой оксиды металлов образуют соответствующие соли, которые имеют различное применение. Например, оксид меди (CuO) взаимодействует с серной кислотой (H2SO4) и образует сульфат меди (CuSO4), который широко применяется в сельском хозяйстве в качестве удобрения, а также в производстве жестких сплавов, красителей и других химических соединений.
Реактивность оксидов металлов
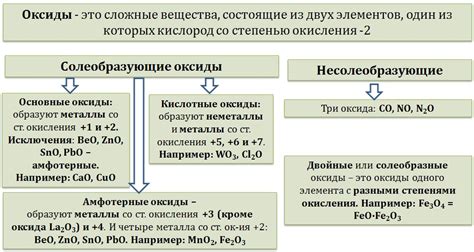
Оксиды металлов являются химическими соединениями, состоящими из металла и кислорода. Они обладают различной реактивностью, которая зависит от свойств самого металла и его оксида. Некоторые оксиды металлов растворяются в воде и образуют щелочные растворы, а другие образуют кислотные растворы.
Реактивность оксидов металлов можно определить по их способности образовывать кислоты или щелочи при взаимодействии с водой или кислотами. Оксиды активных металлов, таких как натрий (Na), калий (K) или кальций (Ca), растворяются в воде и образуют щелочные растворы, которые обладают щелочными свойствами.
Оксиды менее активных металлов, таких как медь (Cu), железо (Fe) или алюминий (Al), не растворяются в воде и не образуют щелочные растворы. Однако они могут образовывать кислотные растворы при взаимодействии с кислотами. Например, оксид алюминия (Al2O3) реагирует с соляной кислотой (HCl) и образует алюминиевый хлорид (AlCl3) и воду.
Реактивность оксидов металлов также может зависеть от их окислительно-восстановительных свойств. Некоторые оксиды металлов могут выступать в реакциях как окислители, при этом сами восстанавливаются, а другие оксиды металлов могут выступать в реакциях как восстановители, при этом сами окисляются. Эти свойства оксидов металлов имеют важное применение в химических процессах, таких как окислительно-восстановительные реакции и электрохимические процессы.
Образование солей при реакции H2SO4 с оксидами металлов
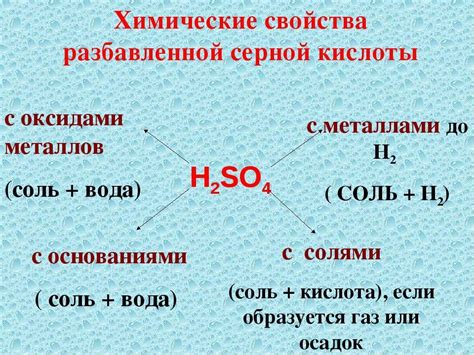
Реакция оксидов металлов с серной кислотой, H2SO4, является одним из способов получения солей. В реакции оксид металла образует с кислородом серную кислоту, а металл переходит в ионное состояние, образуя соль.
Реакционная способность металлических оксидов с серной кислотой зависит от их активности и степени окисления. Если оксид металла образует кислотные оксиды, то он может реагировать с H2SO4, образуя соль и воду.
Реакция между H2SO4 и оксидом металла происходит по следующей схеме:
- Ион водорода H+ от серной кислоты вступает в реакцию с оксидом металла, удаляя из него кислород и образуя воду (H2O).
- Металлический ион соединяется с ионом серной кислоты (SO4^2-), образуя соль.
Образование солей при реакции H2SO4 с оксидами металлов имеет широкое применение. Соли, получаемые из такой реакции, являются основными компонентами многих промышленных и хозяйственных процессов. Они используются в производстве удобрений, стекла, красителей, керамики, косметики и многих других продуктов.
Некоторые соли, полученные из реакции H2SO4 с оксидами металлов, имеют большое значение в медицине и фармацевтике. Например, сернокислые соли представляют собой важные препараты, используемые в лечении заболеваний печени и других медицинских состояний.
Таким образом, реакция H2SO4 с оксидами металлов позволяет получать разнообразные соли, которые находят применение в различных отраслях промышленности и науки.
Использование H2SO4 и оксидов металлов в промышленности

В промышленности H2SO4 и оксиды металлов находят широкое применение в ряде процессов производства различных материалов и веществ. Эти вещества активно используются в химической, металлургической и электронной промышленности, а также в производстве удобрений, растворителей и других химических продуктов.
Кислота H2SO4 применяется, например, в процессе производства удобрений. Она служит для получения суперфосфата, важного минерального удобрения, путем взаимодействия соответствующих оксидов металлов. Кроме того, H2SO4 используется при производстве электролитов для аккумуляторов, а также в осаждении металлов при производстве гальванических покрытий.
Оксиды металлов, такие как оксид железа (Fe2O3) и оксид цинка (ZnO), применяются в металлургической промышленности для получения соответствующих металлов. Например, окисление железа с помощью кислорода приводит к получению железного оксида (Fe2O3), который затем используется для производства стали. Оксид цинка находит применение в процессе гидрометаллургической переработки цинковых руд для получения цинка.
Кроме того, оксиды металлов и H2SO4 используются в производстве керамики и стекла. Они являются важными компонентами при синтезе различных керамических и стеклянных материалов. Оксиды металлов придают им определенные свойства, а добавление кислоты H2SO4 позволяет контролировать процесс синтеза и получить требуемые характеристики.
Использование H2SO4 и оксидов металлов в промышленности является неотъемлемой частью многих процессов производства и играет важную роль в различных отраслях промышленности.
Методы получения оксидов металлов для реакции с H2SO4

Оксиды металлов получают различными методами в зависимости от свойств и особенностей каждого конкретного металла.
1. Обжигание металлов. Один из способов получения оксидов металлов - это обжигание металлических образцов в кислородной среде. При этом происходит окисление металла, формируется оксид, который можно использовать для последующего реагирования с H2SO4. Например, при обжигании железа образуется Fe2O3, который может реагировать с H2SO4.
2. Обработка металлов кислотными реагентами. Некоторые металлы могут быть прямо окислены кислотами для образования оксидов. Например, цинк (Zn) может быть обработан соляной кислотой (HCl), что приводит к образованию цинка хлорида и связанного с ним оксида цинка (ZnO). Этот оксид цинка может быть использован для взаимодействия с H2SO4.
3. Электролиз. Электролиз также может быть использован для получения оксидов металлов. В процессе электрохимической реакции металлический ион окисляется на аноде, образуя оксид металла. Затем этот оксид может быть использован для реакции с H2SO4. Например, при электролизе водного раствора медного (Cu) купрата (CuSO4) в результате окисления меди образуется оксид меди (CuO), который может реагировать с H2SO4.
4. Взаимодействие металлов с кислородом. Некоторые металлы могут быть окислены непосредственно кислородом воздуха, образуя оксиды металлов. Например, при нагревании меди (Cu) воздухе образуется оксид меди (CuO), который может использоваться для реакции с H2SO4.
Практическое применение реакции H2SO4 с оксидами металлов
Реакция между серной кислотой (H2SO4) и оксидами металлов находит широкое применение в различных областях.
Первое практическое применение данной реакции связано с получением соответствующих солей металлов. При взаимодействии оксида металла с серной кислотой образуется соответствующий сульфат металла. Эти соли находят применение в химической промышленности, металлургии, медицине, сельском хозяйстве и других сферах.
Кроме того, реакция H2SO4 с оксидами металлов используется для получения водорода. При этом оксид металла восстанавливается, образуя соответствующий металл, а серная кислота разлагается на воду и диоксид серы. Водород является важным сырьем в различных процессах, включая производство аммиака, металлов, пластмасс и других химических веществ.
Другое практическое применение реакции H2SO4 с оксидами металлов связано с использованием полученных продуктов для очистки и обработки различных материалов. Например, сульфаты металлов используются в горнодобывающей промышленности для выделения полезных ископаемых из руды, а также в процессах очистки воды и воздуха.
Таким образом, реакция H2SO4 с оксидами металлов имеет широкое практическое применение и является важным инструментом в различных областях промышленности и науки.
Вопрос-ответ

Что такое оксиды металлов?
Оксиды металлов - это химические соединения, состоящие из атомов металла и кислорода. Они широко распространены в природе и являются основными составляющими многих минералов. В оксидах металлов металл обычно находится в положительной степени окисления.
Как происходит взаимодействие H2SO4 с оксидами металлов?
При взаимодействии H2SO4 (серной кислоты) с оксидами металлов образуется соль и вода. Происходит реакция нейтрализации, в результате которой оксид металла обесцвечивается и приобретает свойства соли.
Какие применения имеют реакции взаимодействия H2SO4 с оксидами металлов?
Реакции взаимодействия H2SO4 с оксидами металлов имеют широкое применение в различных сферах. Например, эти реакции используются в химической промышленности для получения металлических солей, которые затем используются в производстве лекарств, жидких кристаллов, красителей и других химических соединений. Также эти реакции могут использоваться в аналитической химии для определения наличия и количества определенного металла в образце.
Какие реакции происходят при взаимодействии H2SO4 с оксидами металлов?
При взаимодействии H2SO4 с оксидами металлов происходят реакции нейтрализации. Например, при взаимодействии серной кислоты с оксидом цинка (ZnO) образуется соль - сульфат цинка (ZnSO4) и вода. Аналогично, при взаимодействии H2SO4 с другими оксидами металлов образуются соответствующие соли и вода.
