Серная кислота H2SO4 является одним из наиболее распространенных кислотных соединений, обладающих сильной коррозионной активностью. Она образуется при соединении молекул серни с молекулами кислорода и воды. Эта кислота используется в широком диапазоне промышленных и лабораторных процессов. Она обладает также способностью взаимодействовать с различными металлами, образуя с ними соединения, и проводит ряд химических реакций с ними.
Серная кислота реагирует с многими металлами, такими как железо, цинк, медь и алюминий. В результате таких реакций образуются соединения между серной кислотой и металлом, например, сульфаты. При этом часто выделяется водород, который можно наблюдать в виде пузырьков газа.
Пример реакции:
2H2SO4 + Zn → ZnSO4 + 2H2O + SO2
Реакция серной кислоты с металлами обычно сопровождается выделением тепла, что делает ее очень энергичной и иногда опасной в условиях неправильного обращения с кислотой. Реакция может протекать очень быстро и сопровождаться освобождением токсичных газов, поэтому при работе с серной кислотой необходимо соблюдать меры предосторожности и работать в хорошо проветриваемом помещении.
Влияние серной кислоты H2SO4 на металлы

Серная кислота H2SO4 является одним из наиболее активных и коррозионно-агрессивных веществ в химии. Ее воздействие на металлы приводит к различным химическим реакциям и изменению свойств металлов.
Серная кислота может реагировать с многими металлами, образуя соли или газы. Эта реакция зависит от активности металла. Например, реакция серной кислоты с активными металлами, такими как натрий или калий, протекает с выделением водорода и образованием соответствующих солей (натрия или калия).
Менее активные металлы, такие как железо или цинк, могут реагировать с серной кислотой, но реакция может быть более медленной и неполной. В этом случае образуются соли металлов и водород.
Серная кислота также может реагировать с некоторыми редкоземельными металлами, такими как алюминий или магний, образуя соли этих металлов и водород. Однако эти реакции могут быть менее активными в сравнении с другими металлами.
Более реактивные металлы, такие как калий или натрий, реагируют с серной кислотой даже при низких концентрациях и могут привести к опасным химическим реакциям, таким как выделение газов или возгорание. Поэтому при работе с серной кислотой необходимо соблюдать особые меры безопасности.
Свойства и особенности реакций

Серная кислота (H2SO4) является одной из наиболее распространенных и важных кислот в химии. Свойства этой кислоты определяют ее способность к сильному взаимодействию с различными веществами, включая металлы.
Реакция серной кислоты с металлами представляет собой окислительно-восстановительный процесс, в котором один из компонентов окисляется, а другой восстанавливается. В реакции с металлами серная кислота выступает в качестве окислителя, принимая на себя электроны от металла.
Реакция между серной кислотой и металлом происходит при образовании соли и выделении водорода. При этом серная кислота диссоциирует на ионы водорода (Н+) и сульфатные ионы (SO42-), а металл отдает свои электроны, окисляется и образует ион металла.
Скорость реакции между серной кислотой и металлом зависит от различных факторов, включая концентрацию и температуру реакционной смеси, а также химическую активность металла. Более реактивные металлы, такие как натрий или калий, реагируют с серной кислотой быстро и с выделением большого количества водорода, в то время как менее реактивные металлы, такие как железо или медь, реагируют медленнее.
Реакция между серной кислотой и металлами может быть использована для получения солей металлов, которые имеют различные применения в промышленности и науке. Например, сернокислый натрий Na2SO4 используется в текстильной промышленности, а сернокисло-железистый FeSO4 применяется в медицине.
Реакция металлов с серной кислотой: процессы и примеры
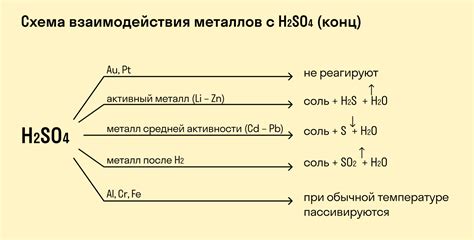
Серная кислота H2SO4 является одной из наиболее распространенных кислот в химии и широко используется в промышленности и лабораторных условиях. При контакте с металлами серная кислота вызывает химические реакции, которые можно классифицировать на основе активности металла.
Активные металлы, такие как натрий (Na), калий (K) и кальций (Ca), реагируют с серной кислотой с выделением водорода (H2) и образованием соли серной кислоты. Например, реакция металла натрия с серной кислотой представлена следующей химической формулой: 2Na + H2SO4 -> Na2SO4 + H2. Подобные реакции происходят с другими активными металлами.
Пассивные металлы, такие как железо (Fe) и алюминий (Al), не реагируют с серной кислотой при обычных условиях. Однако они могут реагировать при высоких температурах или под действием катализаторов. Реакция металла железа с серной кислотой происходит при нагревании и с образованием соли серной кислоты и выделения диоксида серы: 3Fe + 8H2SO4 -> 3Fe2(SO4)3 + 4H2O + 2SO2.
В ряде случаев, реакция металлов с серной кислотой может быть неоднозначной и зависеть от концентрации кислоты, температуры и других факторов. Например, алюминий при обычных условиях реагирует с разведенной серной кислотой, образуя соль алюминия и выделяя водород: 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2. Однако с концентрированной серной кислотой алюминий не реагирует.
Реакция металлов с серной кислотой имеет практическое применение. Например, она используется в процессе очистки металлических поверхностей от оксидов и других загрязнений. Для этого металл погружают в серную кислоту, что приводит к удалению оксидных пленок и образованию чистого металлического поверхностного слоя.
Физические и химические свойства серной кислоты H2SO4
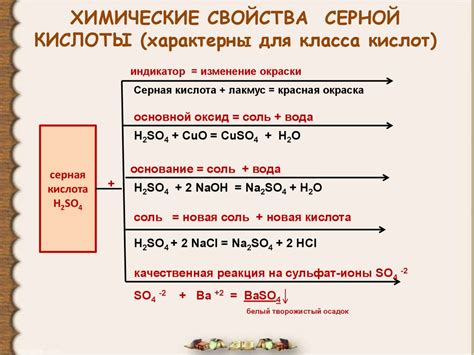
Физические свойства:
- Серная кислота H2SO4 — безцветная жидкость, характеризующаяся высоким кипением и плотностью.
- При комнатной температуре имеет концентрацию около 96%, так как обладает сильными анионами и образует гидратированные ионы.
- Обладает резким запахом и ядовитыми свойствами, что требует осторожного обращения с ней.
- Легко смешивается с водой, сильно нагреваясь, и образует горячий пар.
Химические свойства:
- Серная кислота обладает кислотными свойствами и может реагировать с основаниями, образуя соль и воду.
- Характерной реакцией серной кислоты с металлами является окислительно-восстановительная реакция, в результате которой металл окисляется, а серная кислота восстанавливается.
- Однако, некоторые металлы, такие как золото и платина, не реагируют с серной кислотой.
- При взаимодействии серной кислоты с некоторыми органическими соединениями может происходить не только окисление, но и сульфирование, что используется в промышленности для синтеза органических соединений и лекарственных препаратов.
Таблица 1. Химические свойства серной кислоты H2SO4 с металлами:
| Металл | Реакция с серной кислотой H2SO4 |
|---|---|
| Железо (Fe) | Образование примесей серной кислоты и образование сероводорода (H2S) |
| Медь (Cu) | Реакция, сопровождающаяся выделением кислорода (O2) и образованием соли |
| Цинк (Zn) | Возможно образование сульфата цинка (ZnSO4) и выделение сероводорода (H2S) |
Таким образом, серная кислота H2SO4 обладает высокой химической активностью и может проявлять разнообразные реакции с металлами и органическими соединениями.
Применение серной кислоты H2SO4 в промышленности и повседневной жизни

Промышленное применение:
- Производство удобрений. Серная кислота используется в процессе производства сульфатных удобрений, таких как суперфосфаты и аммиачная селитра. Она играет важную роль в превращении фосфатов и аммиака в растворимую форму, что позволяет растениям легко усваивать эти элементы.
- Производство бумаги. Серная кислота используется в процессе обработки древесины для производства целлюлозы. Она помогает удалить нежелательные компоненты, такие как лигнины, и получить чистую целлюлозу, которая затем используется в производстве бумаги.
- Производство текстильных волокон. Серная кислота применяется в процессе обработки некоторых волокон, таких как хлопок и шелк, чтобы удалить нежелательные примеси, подготовить волокна к окрашиванию и улучшить их прочность.
- Производство пластмасс. В процессе синтеза некоторых видов пластмасс, серная кислота используется в качестве катализатора или реагента, помогающего осуществить реакцию полимеризации и получить требуемый продукт.
Применение в повседневной жизни:
- Аккумуляторы. Серная кислота широко используется в аккумуляторах, где она является одним из главных компонентов электролита. Она позволяет аккумулятору генерировать и хранить электрическую энергию.
- Очистка поверхностей. Серная кислота используется для удаления ржавчины, накипи и других загрязнений с металлических поверхностей. Она обладает сильными восстанавливающими свойствами, что позволяет эффективно очистить различные поверхности.
- Производство косметических средств. Серная кислота может быть использована в некоторых косметических средствах для осветления пигментных пятен на коже или сужения пор. Однако, при использовании таких продуктов необходимо соблюдать осторожность, так как серная кислота может вызвать раздражение или ожоги.
- Очистка стекла. Серная кислота используется в процессе очистки стекла от следов известкового налета, окиси железа или других загрязнений. Она способна легко растворить эти вещества и обеспечить чистоту и прозрачность стекла.
В целом, применение серной кислоты H2SO4 в промышленности и повседневной жизни охватывает много различных областей. Она широко используется в процессах производства удобрений, бумаги, текстильных волокон и пластмасс. Кроме того, она находит применение в аккумуляторах, очистке поверхностей, производстве косметических средств и очистке стекла. Знание свойств и химических реакций серной кислоты позволяет эффективно использовать ее в различных сферах деятельности.
Вопрос-ответ

Какие металлы реагируют с серной кислотой?
Серная кислота обычно реагирует с различными металлами, но скорость реакции и продукты могут зависеть от типа металла. Например, активные металлы, такие как натрий (Na) или калий (K), реагируют с серной кислотой очень быстро, выделяя водород (H2) и образуя сульфат металла (Na2SO4 или K2SO4). Более пассивные металлы, такие как железо (Fe) или медь (Cu), реагируют медленнее и могут образовывать различные продукты, включая сульфаты металла и сернистый газ (SO2).
Какую роль играет серная кислота в реакции с металлами?
Серная кислота H2SO4 является кислотой сильной степени диссоциации, поэтому она может отдавать протоны (H+) в реакции с металлами. Когда металл реагирует с серной кислотой, ионы водорода (H+) из кислоты замещают ионы металла в его соединении. Это приводит к образованию сульфата металла и выделению молекул водорода (H2). Реакция между серной кислотой и металлом является обменной реакцией, где металл замещает водород в кислоте.
