H2SO4, или серная кислота, является одной из наиболее распространенных и важных кислот в химии. Серная кислота обладает сильными кислотными свойствами, что делает ее одной из самых сильных кислот.
Химическая формула H2SO4 указывает на то, что состав этой кислоты включает в себя серу (S) и кислород (O). Эта формула также показывает, что водород (H) присутствует в двойном количестве, что указывает на его кислотные свойства.
Таким образом, H2SO4 является кислотой, а не оксидом металла. Она образуется при реакции серы с кислородом, и обладает выраженными кислотными свойствами в растворе. Серная кислота широко используется в промышленности и научных исследованиях, благодаря своим химическим свойствам и способности реагировать с различными веществами.
Важно отметить, что серная кислота является сильной кислотой и требует особой осторожности при использовании. Она обладает высокой коррозионной активностью и может вызвать тяжелые ожоги на коже и повреждение дыхательных путей при попадании в них. При работе с серной кислотой необходимо строго соблюдать правила безопасности.
Сильная кислота или оксид металла? Разбираемся с H2SO4
H2SO4 или серная кислота является одной из самых сильных кислот, используемых в химической промышленности.
В формуле H2SO4 присутствует сера, которая является неметаллическим элементом, и кислород, который можно считать оксидом металла. Это приводит к интересному вопросу: H2SO4 - сильная кислота или оксид металла?
На самом деле, H2SO4 сочетает в себе и свойства кислоты, и свойства оксида металла. Когда серная кислота реагирует с водой, она образует ион гидро́ния (H+) и ионы сульфата (SO4^2-). Именно эти ионы гидро́ния делают H2SO4 сильной кислотой.
Однако, стоит помнить, что серная кислота также обладает и окислительными свойствами, что свойственно оксидам металлов. Серная кислота может окислять многие вещества, например, превращая железо (Fe) в ион железа (Fe^3+).
Итак, можно сказать, что H2SO4 - это не только сильная кислота, но и оксид металла, объединяющий в себе свойства обоих классов веществ. Это делает ее важным реагентом в различных процессах и промышленности.
Что такое H2SO4?
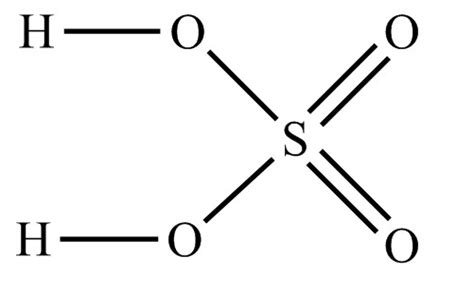
H2SO4 или серная кислота – это одна из самых распространенных и важных кислот в химии. Молекула серной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода, символизируемых формулой H2SO4. Она обладает сильными кислотными свойствами, что делает ее очень активным соединением.
Серная кислота имеет множество применений в различных отраслях промышленности. Она широко используется в химической, фармацевтической и пищевой промышленности, а также в производстве удобрений, покрытий для металлов и бумаги. Серная кислота также применяется в лабораторных условиях при проведении различных химических экспериментов.
Серная кислота обладает эффектными кислотными свойствами, так как легко диссоциирует на ионы в растворе. При взаимодействии с водой происходит образование ионов водорода и сульфата:
H2SO4 + H2O → H3O+ + HSO4-
Серная кислота является дибазической кислотой, то есть может отдавать два нарушенных протона. Также она хорошо растворяется в воде и образует безцветные растворы с высокой степенью кислотности.
Серная кислота является сильным окислителем и может проявлять свои окислительные свойства в ряде реакций. Она может обладать коррозионной активностью и вызывать ожоги при контакте с кожей и слизистыми оболочками. Поэтому при работе с этим веществом необходимо соблюдать особые меры предосторожности и исполнять все правила личной безопасности.
Формула и свойства

H2SO4 - это химическая формула серной кислоты. Эта кислота представляет собой цветную жидкость, которая обладает сильной коррозионной способностью. Она обычно получается путем окисления сероводорода или серы, и часто используется в промышленности для производства различных химических веществ.
Серная кислота имеет высокую концентрацию водных растворов и сильную кислотность. Она является одним из наиболее сильных кислотных соединений известных в химии. Она легко реагирует с различными металлами, окисляя их и образуя соли. Взаимодействие сильной кислоты с металлом может привести к выделению водорода и образованию соли, например, получение сульфата металла.
Кроме того, серная кислота обладает высокой степенью растворимости в воде. Это позволяет ей быть эффективным растворителем для различных химических соединений, таких как сахар, соль, металлические оксиды и многие другие. Кислотные растворы серной кислоты обладают высокой проводимостью электрического тока и могут быть использованы в различных электрохимических процессах.
Также стоит отметить, что концентрированная серная кислота является сильным окислителем, что позволяет ей участвовать в химических реакциях, в которых она окисляет другие вещества. Это свойство позволяет использовать серную кислоту в различных промышленных процессах, таких как производство удобрений, препаратов для добычи полезных ископаемых и других химических соединений.
Кислотные свойства

Кислотные свойства вещества характеризуются его способностью отдавать протоны или образовывать кислотные ионы. Кислотность может быть определена по реакции взаимодействия с основанием, а также по ряду других характеристик, таких как pH и константа ионизации.
H2SO4 - сильная кислота, которая обладает высокой кислотностью. Каждая молекула серной кислоты образует два иона водорода (Н+) при диссоциации, что делает ее одной из наиболее сильных кислот. Эта кислота активно взаимодействует с основаниями, образуя соль и воду.
Кислотные свойства серной кислоты проявляются не только в ее способности взаимодействовать с основаниями. Она также способна реагировать с металлами, образуя соли и выделяя водород. Это реакция типична для кислот сильной степени диссоциации.
Важно отметить, что кислотность вещества зависит от его концентрации. Чем выше концентрация серной кислоты, тем сильнее ее кислотные свойства. Это связано с тем, что при более высокой концентрации большее количество молекул кислоты диссоциирует, образуя ионы водорода.
- Свойства кислоты можно определить по pH-значению. Кислотные растворы имеют pH ниже 7.
- Кислоты могут реагировать с неорганическими и органическими веществами, образуя соли и другие продукты.
- Серная кислота применяется в различных отраслях промышленности и науки, благодаря своим кислотным свойствам и химической активности.
В заключение, серная кислота является сильной кислотой с высокими кислотными свойствами. Она проявляет способность отдавать протоны и вызывать кислотные реакции с основаниями и металлами. Кислотные свойства вещества зависят от его концентрации и могут быть определены по pH-значению.
Применение H2SO4

H2SO4 (серная кислота) является одной из самых важных промышленных химических соединений. Она широко используется в различных отраслях промышленности и научных исследованиях.
Применение H2SO4:
- Производство удобрений: H2SO4 используется в качестве сырья при производстве азотных, фосфорных и калийных удобрений. Она помогает улучшить рост и качество растений.
- Производство синтетических материалов: H2SO4 используется в процессе производства материалов, таких как пластик, резина, текстильные волокна и красители.
- Гальванические процессы: H2SO4 применяется в электрохимических процессах, таких как гальваническое покрытие металлов и аккумуляторных батареях.
- Очистка и обработка руд: H2SO4 используется в процессах очистки и обработки руд для получения металлических элементов, таких как цинк, медь и никель.
- Аналитическая химия: H2SO4 используется в качестве реактива при проведении различных аналитических методов для определения концентрации и наличия веществ.
Кроме того, серная кислота является важным компонентом при производстве многих других химических веществ, включая кислоты, соли и эфиры.
Важно отметить, что H2SO4 - сильная кислота, и ее использование требует осторожности и соблюдения правил безопасности. Неправильное обращение с ней может вызвать серьезные химические ожоги и другие опасные последствия.
Безопасность использования

При работе с серной кислотой H2SO4 необходимо соблюдать надлежащие меры безопасности, так как данное вещество является сильной кислотой и может быть опасным при неправильном обращении.
Первое и самое важное правило – носить защиту для глаз и рук. При взаимодействии H2SO4 с органическими веществами может произойти выделение токсичных газов и паров. Поэтому необходимо работать в хорошо проветриваемом помещении или под вытяжкой, а также надевать специальные защитные очки с боковой защитой и резиновые перчатки.
Для избежания попадания H2SO4 на кожу, рекомендуется использовать защитную одежду – фартук, химически устойчивые ботинки и головной убор. В случае попадания кислоты на кожу необходимо немедленно промыть ее большим количеством воды и посетить врача.
Кислоту H2SO4 следует хранить в хорошо вентилируемом и отдаленном от остальных химических веществ месте. Хранение должно осуществляться в плотно закрытом и безопасном контейнере, обязательно с указанием содержимого.
При разбавлении H2SO4 в воде необходимо действовать осторожно, вначале следует добавить кислоту в воду, а не наоборот, чтобы избежать возможного брызгания или взрыва. Разбавлять следует постепенно и аккуратно, при этом ни в коем случае нельзя наклоняться над стеклянными посудинами.
Важно помнить, что кислота H2SO4 является коррозивным веществом и может повредить различные материалы, включая металлы. При работе с ней следует избегать контакта с одеждой, ковровыми покрытиями и другими предметами. В случае попадания кислоты на предметы необходимо немедленно промыть их большим количеством воды.
При правильном обращении с кислотой H2SO4 можно избежать многих опасностей и обеспечить сохранность своего здоровья и окружающей среды.
Вопрос-ответ

Что такое H2SO4?
H2SO4 – это химическое соединение, известное как серная кислота. Она является одной из самых распространенных и важных химических веществ. Серная кислота представляет собой безцветную, вязкую жидкость, имеющую характерный запах и сильно коррозионные свойства.
Какова роль H2SO4 в промышленности?
H2SO4 имеет множество применений в промышленности. Она используется в производстве удобрений, пластмасс, текстиля, жидкого очистителя для туалетов и многих других продуктов. Серная кислота также широко применяется в химическом анализе и синтезе.
Почему H2SO4 считается сильной кислотой?
Серная кислота (H2SO4) считается сильной кислотой из-за своей способности диссоциировать в воде и отдавать H+-ионы. При взаимодействии с водой молекулы серной кислоты расщепляются на ионы: H2SO4 -> 2H+ + SO4(2-). Такая диссоциация полностью и необратима, что указывает на высокую кислотность этого соединения.
