Вода - одно из самых важных и распространенных веществ на Земле. Она играет ключевую роль во многих процессах и явлениях, которые оказывают влияние на природу и жизнь всех организмов. Но какова природа воды и к какому классу элементов она может быть отнесена - металлам или неметаллам? Этот вопрос интересует многих ученых и вызывает дебаты уже в течение многих лет.
Согласно периодической системе элементов, вода - это соединение двух элементов, гидрогена и кислорода. Сам по себе гидроген относится к неметаллам, тогда как кислород - к широко известной группе элементов, называемой кислородосодержащими неметаллами. Вода обладает свойствами и характеристиками, которые можно отнести к обоим классам элементов.
Химический состав воды

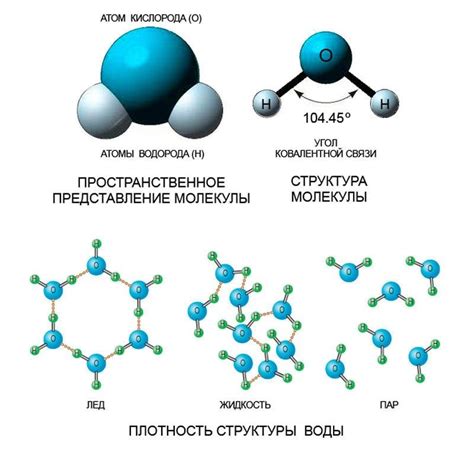
Вода - одна из самых распространенных и важных химических соединений на Земле. Химический состав воды состоит из двух атомов водорода и одного атома кислорода, образуя молекулу H2O. Воду можно рассматривать как комплексное вещество, так как ее составные атомы могут проявлять особые свойства и реактивность.
Молекула воды обладает положительным и отрицательным электрическим зарядом. Этот электрический дипольный момент делает воду уникальным веществом, способным взаимодействовать с другими веществами, растворять их и быть растворенной самой.
Вода содержит ряд ионов, таких как гидроксидные (OH-) и оксониевые (H3O+) ионы, образующиеся при диссоциации воды. Также вода может содержать различные примеси, такие как минеральные соли, газы и органические вещества, в зависимости от места и условий ее образования.
Химический состав воды может изменяться в зависимости от источника и обработки. Например, морская вода содержит большее количество солей и минералов, чем пресная вода. Вода из различных источников может содержать разные примеси, такие как хлор, фтор, железо и другие химические элементы.
Выводящий кран водопровода часто проходит процесс очистки и фильтрации, чтобы удалить примеси и загрязнители и сделать воду безопасной для питья. Вода, которую мы используем в быту и промышленности, проходит обработку и может содержать различные добавки, такие как хлор или флуориды, для обеспечения безопасности и сохранения качества.
Физические свойства воды
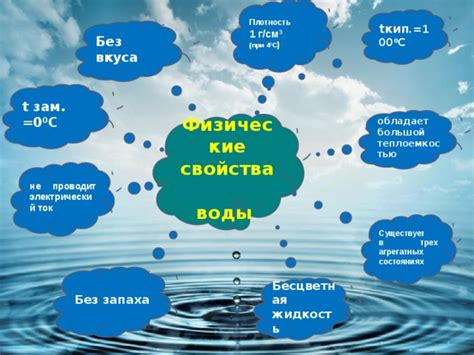
Точка кипения: Вода является жидкостью при комнатной температуре, но при достижении своей точки кипения, которая равна 100 градусам Цельсия на уровне моря, она превращается в водяной пар. Интересно отметить, что точка кипения воды может меняться в зависимости от давления.
Точка замерзания: Вода имеет очень высокую точку замерзания, равную 0 градусам Цельсия на уровне моря. Это означает, что при понижении температуры до 0 градусов Цельсия, вода превращается в лед. Благодаря этому свойству вода играет важную роль в нашей окружающей среде, так как лед на поверхности воды помогает сохранить под ними жизнь в океанах и озерах.
Плотность: Вода имеет высокую плотность, что означает, что она тяжелее многих других жидкостей. Это свойство делает ее идеальным средством для плавания и поддержания тела на воде. Кроме того, плавучесть воды используется при постройке кораблей и плотов.
Капиллярность: Вода обладает способностью подниматься вверх по узким каналам, таким как поры грунта или тонкие строительные материалы. Это свойство, известное как капиллярность, играет важную роль в растениях, помогая им поддерживать поступление воды и питательных веществ к корням.
Растворимость: Вода является превосходным растворителем и способна растворять множество веществ. Благодаря этому свойству она участвует во многих химических реакциях в нашем организме и окружающей среде.
Теплоемкость: Вода обладает высокой теплоемкостью, что означает, что ее температура меняется медленно. Это свойство играет важную роль в регуляции климата и поддержании стабильной температуры окружающей среды.
Теплопроводность: Вода является плохим проводником тепла, что делает ее полезной в роли теплоизоляции. Например, ее использование в системах охлаждения помогает предотвратить перегрев двигателя.
Таким образом, физические свойства воды делают ее уникальным и важным веществом в нашей жизни и окружающей среде.
Химические свойства воды

Вода - это уникальное вещество, которое обладает разнообразными химическими свойствами. Одно из основных свойств воды - ее способность образовывать водородные связи. Эта особенность делает воду идеальным растворителем для многих веществ, так как она способна взаимодействовать с различными молекулами и ионами.
Одно из важных химических свойств воды - ее способность быть кислотной или щелочной. Благодаря этому свойству, вода может служить как кислотным раствором (если содержит большее количество положительных ионов) так и щелочным раствором (если содержит большее количество отрицательных ионов).
Вода также обладает поверхностным натяжением, это свойство позволяет ей образовывать пленку на поверхности, которая способна выдерживать натяжение. Это свойство важно для таких явлений, как капиллярное воздействие и гидрофобность.
Еще одно важное свойство воды - это ее способность изменять свое объемное содержание при изменении температуры. Это свойство, называется термическим расширением, позволяет воде под действием тепла расширяться и сжиматься.
Способность воды образовывать «твердую» фазу - лед и «газообразную» фазу – водяной пар, является еще одним химическим свойством. Переход воды из жидкого состояния в твердое происходит при низкой температуре, а в газообразное состояние – при нагревании.
Реакции воды с другими веществами

Вода, благодаря своим уникальным свойствам, испытывает реакции с различными веществами, что делает ее идеальным растворителем и реагентом в химических процессах.
Первым важным типом реакций воды является реакция с металлами. Вода может реагировать с активными металлами, такими как натрий, калий и цезий, образуя гидроксиды и выделяяся водород. Эта реакция является химически активной и может сопровождаться выбросом газа и образованием плавящейся щелочной субстанции.
С другой стороны, вода не реагирует с неметаллическими элементами, такими как кислород или азот. Однако она может образовывать с ними водородные связи, что в свою очередь влияет на свойства и структуру молекулы воды.
Также вода способна реагировать с кислотами и основаниями, проявляя свойства амфотерного соединения. Она может образовывать с кислотами соли и соединения, а с основаниями - гидроксиды.
Кроме того, вода может растворять множество веществ, образуя растворы. Благодаря этой способности, вода является незаменимым растворителем для химических реакций и биологических процессов в организмах.
Таким образом, реакции воды с другими веществами имеют разнообразные проявления и являются основой многих химических и биологических процессов в природе.
Вода как растворитель

Вода – уникальное вещество, которое обладает свойствами и металлов, и неметаллов. Одно из самых удивительных свойств воды – ее способность растворять множество веществ.
Вода является отличным растворителем для множества веществ благодаря своей полярной структуре. Молекулы воды состоят из одного атома кислорода и двух атомов водорода, и обладают положительным и отрицательным зарядами соответственно. Эта полярность позволяет молекулам воды притягивать разные ионы и полярные молекулы, что облегчает их растворение.
Вода может растворять множество солей, кислот, щелочей, органических и неорганических веществ. Она играет важную роль в жизни организмов, так как большинство биологических реакций происходит в водной среде.
Кроме того, вода способна образовывать растворы разной концентрации. Степень растворимости вещества зависит от его химических свойств и условий, в которых происходит процесс растворения.
Выводы: вода является уникальным растворителем, которое обладает свойствами и металлов, и неметаллов. Ее способность растворять различные вещества обусловлена положительными и отрицательными зарядами молекул воды, а также ее полярной структурой. Вода играет важную роль в жизни организмов и является неотъемлемой составляющей многих биологических процессов.
Вопрос-ответ

Может ли быть вода металлом?
Нет, вода не может быть металлом. Вода является химическим соединением молекул, состоящих из атомов кислорода и водорода. Металлы, в свою очередь, характеризуются сетью ионов, в которой электроны свободно передвигаются между атомами. Такие свободные электроны позволяют металлам быть хорошими электропроводниками, однако в молекулах воды электроны плотно связаны и не могут двигаться свободно.
Какие свойства воды определяют ее как неметалл?
Вода обладает рядом характеристик, которые свойственны неметаллам. Например, вода имеет низкую электропроводность, поскольку электроны в молекулах воды плотно связаны. Кроме того, вода является плохим теплопроводником и имеет достаточно низкую плотность. Эти свойства указывают, что вода не обладает характеристиками металлов, такими как хорошая электропроводность и высокая плотность.
Что делает воду такой уникальной с точки зрения химических свойств?
Вода обладает рядом уникальных химических свойств, которые делают ее непохожей на другие вещества. Во-первых, вода обладает высокой теплоемкостью, что означает, что для нагревания ее требуется большое количество энергии. Это позволяет воде удерживать тепло и поддерживать стабильную температуру окружающей среды. Во-вторых, вода образует специфическую структуру в замерзшем состоянии - лед имеет более кристаллическую структуру, чем жидкая вода. Это свойство позволяет льду быть легче жидкой воды и плавать. Кроме того, молекулы воды обладают полярностью, что позволяет им образовывать водородные связи друг с другом и своим окружением.