Группа щелочных металлов включает в себя элементы первой группы периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой химической активностью и являются самыми реактивными металлами. Все щелочные металлы имеют один электрон в внешней оболочке, что делает их очень реактивными и легко образующими ионы положительного заряда.
Одной из особенностей группы щелочных металлов является их низкая плотность. Например, литий – самый легкий металл, плотностью меньше, чем у воды. Это делает их также очень мягкими и низкотемпературными металлами. Они легко режутся ножом, что делает возможным изготовление металлических цилиндров или полосок для использования в различных приложениях и технологиях.
Другой особенностью щелочных металлов является их способность образования водорастворимых гидроксидов, которые образуют щелочные растворы. Например, гидроксид натрия, широко известный как гашеная известь, используется в различных промышленных процессах и в быту. Взаимодействие щелочных металлов с водой может быть очень интенсивным и даже вызывать химические реакции, такие как выделение водорода.
В целом, группа щелочных металлов обладает рядом уникальных химических и физических свойств, которые придают им большую значимость в различных областях. Они широко используются в батареях, стеклах, фотоэлементах, металлургии и других отраслях промышленности. Изучение этих металлов представляет большой интерес для науки и технологий.
Щелочные металлы: свойства и характеристики

Щелочные металлы - это элементы I группы периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой химической реактивностью и обладают рядом общих свойств и характеристик.
Первое и наиболее заметное свойство щелочных металлов - их мягкость. Они являются самыми мягкими металлами в периодической системе и могут быть нарезаны ножом или легко деформированы при малейшем давлении. Их низкая температура плавления также свидетельствует о слабой связи между атомами.
Щелочные металлы обладают высокой электроотрицательностью и хорошей способностью образовывать соединения с другими элементами. Они быстро реагируют с водой, выделяя газ водород и образуя щелочные растворы. Это является одной из самых характерных реакций щелочных металлов и используется для получения водорода и производства щелочных растворов.
Щелочные металлы имеют низкую плотность, что делает их легкими элементами. Они обладают хорошей проводимостью электрического тока и тепла. Благодаря этим свойствам они широко применяются в производстве аккумуляторов, сплавов, проточке металлов и других промышленных процессах.
Свойства щелочных металлов меняются по мере движения по группе. Литий, наименьший элемент группы, имеет наименьшую плотность и наиболее высокую температуру плавления. Натрий, калий и другие металлы в этой группе имеют большую плотность и более низкую температуру плавления.
Химические свойства и реактивность

Группа щелочных металлов включает элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают сильно щелочными свойствами, что проявляется в их реакциях с водой и кислородом.
Щелочные металлы легко реагируют с водой, образуя гидроксиды, гидроген и выделяя большое количество тепла. Металлы этой группы имеют способность образовывать сильные основания, благодаря чему они широко используются в различных отраслях промышленности.
Они также реагируют с кислородом, образуя оксиды щелочных металлов. Эти оксиды обладают щелочными свойствами и способны растворяться в воде, образуя щелочные растворы. Также щелочные металлы реагируют с многими другими элементами, образуя соединения различной степени окисления.
Отдельные щелочные металлы имеют свои особенности в реакциях. Например, литий является наиболее реакционным и легким металлом в этой группе, реагируя даже с азотной кислотой. Самым реакционным из щелочных металлов является цезий, который может реагировать с водой даже при низких температурах.
Таким образом, химические свойства и реактивность щелочных металлов определяют их уникальную роль в химических и промышленных процессах, а также в различных научных исследованиях.
Физические свойства и особенности

Группа щелочных металлов включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются рядом физических свойств, которые являются особенными и характерными для данной группы элементов.
Реактивность: Щелочные металлы являются самыми реактивными из всех элементов. Они активно реагируют с водой, выделяя водород и образуя щелочные растворы. Также они способны образовывать соединения с кислородом, хлором и другими элементами.
Мягкость: Щелочные металлы имеют низкую твердость и обладают металлической гибкостью. Их можно резать ножом и легко согнуть. Литий является самым мягким из них, а цезий - самым твердым.
Плавление и кипение: Точки плавления и кипения щелочных металлов относительно низкие. Например, у лития точка плавления составляет около 180°C, а кипение происходит при температуре около 1342°C.
Цвет и блеск: Щелочные металлы обладают характерным металлическим блеском. Однако они также могут проявлять яркие цвета при образовании различных соединений.
Плотность: У щелочных металлов относительно низкая плотность. Например, у лития она составляет около 0,53 г/см³, а у цезия - около 1,9 г/см³.
Применение в промышленности и научных исследованиях
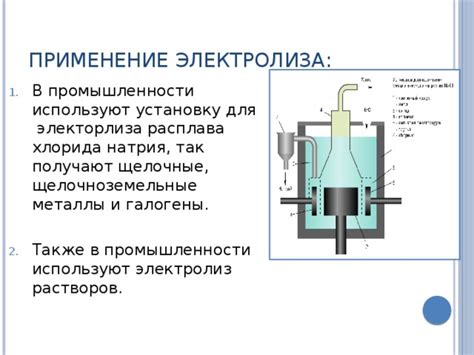
Группа щелочных металлов, включающая литий, натрий, калий, рубидий и цезий, имеет широкое применение как в промышленности, так и в научных исследованиях.
Один из главных применений щелочных металлов - производство щелочей. Натрий и калий широко используются для производства каустической соды, которая является одним из важнейших химических продуктов. Каустическая сода применяется в текстильной, стекольной, пищевой, фармацевтической и других отраслях промышленности. Калий также используется для производства калийных удобрений, особенно в сельском хозяйстве.
Щелочные металлы нашли свое применение и в электрохимической промышленности. Литий используется в производстве литиевых ионных аккумуляторов, которые широко применяются в электронике и автомобильной промышленности. Калий и натрий используются для производства электролитов в электролитических процессах, таких как алюминиевая электролиз и производство хлора.
В научных исследованиях щелочные металлы также играют важную роль. Литий, например, применяется в экспериментах с ядерной физикой и фотохимии. Натрий используется в оптических и осветительных системах. Рубидий и цезий нашли применение в атомных часах, лазерных системах и в исследованиях в области физики атомного строения.
Практические советы по использованию щелочных металлов

Щелочные металлы имеют широкое применение в различных сферах жизни. Они обладают высокими химическими активностью и реакционностью, что делает их ценными элементами. Вот несколько практических советов по использованию щелочных металлов:
- Безопасность основной приоритет: При работе с щелочными металлами необходимо соблюдать все необходимые меры безопасности. Для защиты рук рекомендуется использовать перчатки, специальную защитную одежду и очки.
- Хранение в безвоздушной среде: Щелочные металлы очень реактивны с воздухом и водой, поэтому для их хранения необходимо использовать безвоздушные контейнеры или специальные покрытия, чтобы предотвратить окисление.
- Осторожное обращение с водой: Щелочные металлы реагируют с водой, выделяя горючие газы и создавая пожароопасность. При работе с водой необходимо быть очень осторожным и принимать все меры предосторожности.
- Создание специализированных сплавов: Щелочные металлы можно использовать для создания специализированных сплавов, которые обладают особыми свойствами. Например, легированный натрий используется для производства алюминия и других металлов.
- Применение в электронике: Щелочные металлы, особенно литий, широко используются в производстве аккумуляторов и других устройств электроники. Они обладают высокой энергетической плотностью и долгим сроком службы.
Использование щелочных металлов требует особого внимания и знания их химических свойств. Однако, правильное и безопасное использование этих металлов может принести много пользы в различных отраслях науки и промышленности.
Вопрос-ответ

Какие элементы входят в группу щелочных металлов?
Группа щелочных металлов включает в себя следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие особенности имеют щелочные металлы?
Основные особенности щелочных металлов включают высокую реактивность, низкую плотность, низкую температуру плавления и кипения, а также хорошую проводимость электричества и тепла.
Какие презентации можно сделать о группе щелочных металлов?
Презентация о группе щелочных металлов может содержать информацию о химических свойствах каждого элемента, их распространении в природе, основных применениях и значении для жизни человека, а также об опасностях, связанных с их хранением и использованием.
